مطالعه بنیادین بر روی مقاومت به خوردگی پوشش آلیاژی Zn-Ni - فرایند بنیادین آبکاری آلیاژهای Zn-Ni
- مقالات علمی
- بازدید: 7277
فهرست مطلب
2. فرایند بنیادین آبکاری آلیاژهای Zn-Ni.
2-1 ویژگی کلی پوشش غیر عادی آلیاژ
در ترسیب (تخلیه بار الکتریکی) همزمان یون های مختلف فلزی که پتانسیل های تعادلی آنها چندان باهم فرقی ندارند، به طور عمده سهم فلز نجیب تر به علت تمایل بیشتر برای ترسیب، در پوشش بیشتر است. هنگامی که پتانسیل های الکترود تنهای فلزات خیلی باهم متفاوت باشند، بسیار دشوار خواهد بود تا با تغییر نسبت غلظت یونهای فلزی پتانسیل تعادلی آنها را در محلول بهم نزدیک کرد، و تقریبا بعید است که پتانسل تعادل کاتد نسبت به فلز کمتر نجیب پلاریزه شود. بنابراین، امکان پوشش آلیاژی وجو ندارد، مگر اینکه فعالیت یون فلز نجیب در محلول به طور قابل توجهی توسط تشکیل یک کمپکس پایدار کاهش یابد. از سوی دیگر، در ترسیب آلیاژهای فلزات گروه آهن با Zn یا Cd و همچنین آلیاژهای دوفلزی از فلزات گروه آهن مانند Fe-Ni و Fe-Co، این رفتار غیر عادی بعنوان ترسیب ارجح فلز کمتر نجیب حتی در ترسیب همزمان یونهای هیدراته به نظر می رسد. این دسته پوششهای آلیاژی عموما "نوع غیر طبیعی" نامیده می شود [7]. در تمام سیستم های آلیاژی که در بالا ارائه شده است، فلزات گروه آهن لزوما نسبت به سایر اجزا نجیب تر هستند اما چنین پوشش غیر طبیعی هرگز در سیستم آلیاژی فلزات گروه آهن با مس تشکیل نخواهد شد چراکه فلزات گروه آهن نسبت به مس کمتر نجیب هستند. فلزاتی که نسبت به فلزات گروه آهن کمتر نجیب هستند (پتانسیل الکترودهای استاندارد فلزات گروه آهن در مقابل NHE برای Ni، Co و Fe به ترتیب0.25-، 0.28- و 0.44- V [8]) و یونهای هیدراته آنها قادر هستند بر روی یک الکترود جامد در یک بازده جریان مشخص ترسیب شوند به تعداد کمی از فلزات محدود هستند که عبارتند از: (V0.4-) Cd، (V0.76-) Zn و (V1.18-) Mn [9]. در واقع این مسئله به این واقعیت منجر می شود که پوشش آلیاژی غیر طبیعی فقط در تعداد کمی از آلیاژ هایی که در بالا توضیح داده شد اتفاق می افتد.
2-2. خصوصیات متداول فلزات گروه آهن که ممکن است به ایجاد پوشش غیر طبیعی آلیاژی منجر شود:
علاوه بر نوع غیر طبیعی پوشش که پیشتر گفته شد، نوع دیگری از پوشش غیر معمول آلیاژی نیز وجود دارد که "نوع القا شده" نامیده می شود و در آن یک فلز بی میل مانند Mo یا W، که به تنهایی قابل ترسیب نیست، همراه با یک فلز از گروه فلزات آهن قابل ترسیب می شود [7]. بسیار جالب است که یک فلز گروه آهن لزوما یکی از اجزای تشکیل دهنده سیستم های آلیاژی غیر عادی است. این بدان معنی است که تشکیل آلیاژ غیر عادی باید به خصوصیات متمایز فلزات گروه آهن نسبت داده شود. از آنجایی که ترسیب فلزات از محلول های آبی به طور مستقیم با واکنش احیای هیدروژن بر روی کاتد در حال رقابت است، قابلیت ترسیب یک فلز خاص باید با میزان احیای نسبی هیدروژن و یونهای فلزی بر روی این فلز تعیین شود. این بدان معنی است که خواص فلز در هر دو حالت فلزی و یونی امکان ترسیب فلز را تعیین میکند، زیرا پتانسیل استاندارد الکترود یون فلزی/ فلز، بستگی به ثبات و به این ترتیب به خواص عنصر فلزی در هر دو حالت بستگی دارد، در حالی که اور پتانسیل هیدروژن به خواص حالت فلزی بستگی دارد.
خواص حالت یونی:
در میان فلزاتی که می توانند از محلول های آبی خودشان ترسیب شوند، تنها فلزات گروه آهن دارای اور پتانسیل هستند. فلزات گروه آهن در پتانسیلی که چند دهم کمتر از پتانسیل تعادلی واقعی آنها است شروع به ترسیب میکنند [10]، این درحالی است که اکثر فلزات دیگر در پتانسیل تعادلی خود ترسیب می شوند. این بدان معنی است که سایت های ترسیب شدن برای فلزات گروه آهن به طور قابل ملاحظه ای در کاتد محدود می شوند. بنابراین، می توان نتیجه گرفت هنگامی که سایتهای ترسیب بر روی کاتد توسط جذب مواد خارجی اشغال می شوند، باعث می شوند تا ترسیب فلزات گروه آهن به راحتی قطبی تر شوند. از سوی دیگر، از آنجایی که ترسیب فلزات گروه آهن ظاهرا (اما نه از منظر ترمودینامیکی) در پتانسیلهای کمتر از پتانسیل های تعادلی آنها اتفاق می افتد، ترسیب آنها میتواند در حضور کاتالیست های خاصی نسبت به پتانسیلهای تعادلیشان دپلاریزه شود. در مطالعۀ پلاروگرافی ترسیب نیکل به خوبی مشخص شده است که هنگامی که ترکیبات S- و N در الکترولیت وجود دارند به علت اتصالات آنیونی یا کمپلکس سطحی، pre-wave کاتالیزوری مشاهده می شود. [11] - [16]. بنابراین، پتانسیل ترسیب و به همین ترتیب پتانسیل تعادل ظاهری فلزات گروه آهن، به طور قابل ملاحظه ای با جذب مواد خارجی مانند مهار کننده یا کاتالیزور در این سایت ها تحت تاثیر قرار می گیرد.
به خوبی مشخص شده است که هیدروژن و همچنین فلزات گروه آهن ، دارای اور پتانسیل ترسیب هستند که به طور کلی به نام اور پتانسیل هیدروژن نامیده می شود. احیای هیدروژن بر روی الکترود جیوه که دارای اور پتانسيل بالای هیدروژن است، در حضور ترکیبات S- و N- بطور قابل ملاحظه ای دپلاریزه می شود [17]. این نکته نشان می دهد که هیدروژن دارای ویژگی هایی مشابه با فلزات گروه آهن است. از آنجا که در ترسیب یک فلز از محلول آبی (هنگام آبکاری) همیشه باید رفتار یون هیدروژن در نظر گرفته شود، این ویژیگی را نیز باید بطور مداوم در نظر داشت.
خواص در حالت فلزی:
از فلزاتی که می توانند از محلول های آبی خودشان ترسیب شوند، تنها فلزات گروه آهن، فرومغناطیس هستند. این به علت ساختار الکترونی فلزات گروه آهن است که تا اندازه ای با فلزات دیگر متفاوت است که آنها تعدادی الکترون جفت نشده (Fe 2.2، Co 1.6، Ni 0.6) دارند، و به علت توزیع غیر یکنواخت حفرات در دو زیر لایه d3 است [18]. وجود این الکترونهای جفت نشده، باعث شده تا فلزات گروه آهن در میان فلزاتی که می توانند از محلول های آبی با بازده جریان کاتدی بالا ترسیب شوند، بالاترین میزان گرمای جذب هیدروژن اتمی و همچنین تمایل زیاد برای جذب ترکیبات حاوی S- و N- که جفت الکترون تنها دارند، داشته باشند (جدول 2) [19]، [20]. بنابراين، فلزات گروه آهن داراي توانايي بالايي براي نگهداري موادي مانند هيدروژن اتمي و ترکیبات حاوی S- و -N در سطح خود هستند.
جدول 2 گرمای جذب هیدروژن اتمی بر روی فلزات مختلف (kJ / mol).
|
Ga* |
Fe* |
Al |
Cu* |
Cr |
Cd* |
Be |
Au* |
Ag* |
|
236.5 |
253.2 |
244.8 |
251.5 |
225.6 |
243.6 |
248.2 |
242.7 |
240.6 |
|
Pd |
Pb* |
In* |
Ni* |
Nb |
Mo |
Mn |
Mg |
Hg* |
|
249.0 |
232.7 |
251.9 |
283.3 |
275.4 |
240.6 |
228.9 |
236.5 |
221.4 |
|
Zn* |
W |
V |
Tl* |
Ti |
Ta |
Pt |
||
|
229.8 |
287.1 |
258.2 |
231.4 |
255.3 |
287.1 |
263.2 |
⃰ فلزاتی که می توانند از محلول آبی با بازده جریان بالا ترسیب شوند
بر اساس خصوصیات متمایز فلزات گروه آهن که در بالا شرح داده شده است، نویسندگان حاضر پیشتر یک مکانیزم احتمالی برای ترسیب دوتایی القاشده Mo با فلزات گروه آهن پیشنهاد کرده اند و توضیح دادند که ترسیب آلیاژی نوع القا شده در شرایطی اتفاق می افتد که در آن جنبه های مطلوب خواص فلزات گروه آهن، از جمله دپلاریزاسیون ترسیب فلز گروه آهن و توانایی بالا برای نگه داشتن هیدروژن اتمی، مجاز به عملکرد خوب در ترکیب بودند، در حالی که ترسیب آلیاژی هرگز در شرایطی که خواص در حالت فلزی به دلیل خواص نامطلوب در حالت یونی، مانند پلاریزه شدن ترسیب فلزات گروه آهن قادر به عملکرد مطلوب نیست، اتفاق نخواهد افتاد [21] - [27].
از سوی دیگر، در ترسیب آلیاژی غیر طبیعی عموما پوشش مبتنی بر حضور درصد کمی از فلزات گروه آهن است، از سوی دیگر خواص فلزات گروه آهن در حالت فلزی ممکن است هیچ نقشی نداشته باشند، زیرا برای مثال اوربیتالهای d3 فلزات گروه آهن توسط الکترونهایs 4 زینک در آلیاژهای Zn با فلزات گروه آهن پر می شود.
2-3. مکانیسم مهار هیدروکسید
در حمام سولفاتی، فلزات گروه آهن و Zn موجود، در ساده ترین شکل یون آبپوشیده خود هستند. ترسیب Ni دریک حمامی که بعنوان مثال حاوی 0.9 مول بر لیتر یون فلزی است در حدود 0.43- ولت در مقابل NHE شروع می شود که عملا V 0.18 کمتر از پتانسیل تعادلی خود (0.25- ولت) می باشد[28]. به این ترتیب Ni، و همچنین سایر فلزات گروه آهن دارای اورپتانسیل ذاتی ترسیب هستند. با این حال، این اورپتانسیل ترسیب به اندازه کافی بزرگ نیست تا بتواند پتانسیل تعادلی ظاهری نیکل را که پتانسیل ترسیب نیکل است به پتانسیل تعادل Zn (غلظت روی 1 مول بر لیتر پتانسیل ترسیب آن معادل 0.76- ولت) نزدیک کند. بنابراین، نمیتوان ترسیب Zn بعنوان فلز عمده در پوشش آلیاژی را با توجه به اینکه بطور قابل توجهی از فلزات گروه آهن کمتر نجیب است صرفا با توجه با اور پتانسیل ذاتی فلزات گروه آهن توضیح داد چراکه عملا غیر ممکن است. همانطور که قبلا ذکر شد، ترسیب الکتریکی فلزات گروه آهن به راحتی تحت تاثیر جذب مواد خارجی مانند مهار کننده ها یا کاتالیزور در محل های ترسیب شدن آنها قرار می گیرد. بنابراين برای اینکه آلیاژی با درصد غالب Zn داشته باشیم، حضور بازدارنده در حمام جهت کنترل ترسیب فلزات گروه آهن ضروری می باشد. در ترسیب آلیاژی Zn با فلزات گروه آهن، به دلیل افزایش PH در مجاورت کاتد، هیدروکسید فلزی تشکیل شده ناشی از هیدرولیز به عنوان یک مهارکننده در نظر گرفته می شود [29]، [30].
2-3-1. انتقال رفتار ترسیب آلیاژی از نوع عادی به نوع غیر عادی و تشکیل هیدروکسید زینک [31]، [32].
به طور کلی، در ترسیب غیر عادی آلیاژ، تغییر ایجاد شده در ترکیب آلیاژ بوسیله تغییر متغیرهای آبکاری به ندرت یک تمایل (روند) مشخص را نشان می دهد [7]، و مشخصا این موضوع در زمانی که دانسیته جریان متغیر است، بیشتر دیده می شود. شکل 3 نتایج تجربی تاثیر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ را نشان می دهد. شرایط استاندارد آبکاری در جدول 3 آورده شده است. خط نقطه چین در شکل 3 خط مرجع ترکیب را نشان می دهد (در ادامه برای سادگی بصورت CRL اشاره می شود) و موقعیتی را نشان می دهد که در آن ترکیب درصد وزنی آلیاژ درست با ترکیب درصد فلز در حمام برابر است.
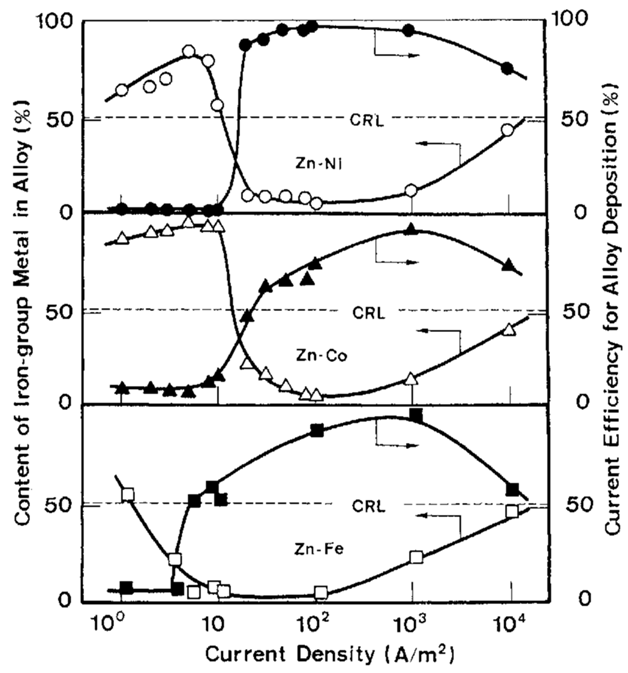
شکل 3: تاثیر دانسیته جریان بر روی ترکیب پوشش آبکاری شده، بر روی کاتد، بازده جریان برای ترسیب آلیاژ
جدول 3 شرایط استاندارد آبکاری برای آلیاژهای فلزات گروه آهن و Zn
|
Operating condition |
Bath composition |
|
Current density 10A/dm2 |
Zinc sulfate 0.5 mol/l |
|
Electrolysis 100s duration |
Iron-group metal sulfate 0.5 mol/l |
|
Quiescent bath |
Sodium acetate 0.2 mol/l |
|
Sulfuric acid ⃰ |
⃰ مقدار مورد نیاز برای تنظیم pH در 3.0
در مواردی که میزان فلز گروه آهن در آلیاژ، بالای خط CRL باشد، ترسیب الکتریکی از نوع معمولی رخ می دهد، چون در مقایسه با حمام، نسبت فلز گروه آهن به Zn در آلیاژ بیشتر است و از این رو ترسیب الکتروشیمیایی فلز گروه آهن ارجح می باشد. از سوی دیگر، میزان فلز گروه آهن زیر خط CRL نشان دهنده ترسیب دوتایی غیرمعمول است که در آن گونه ارجح برای ترسیب Zn کمتر نجیب می باشد.
در دانسیته جریان های پایین، ترسیب دوتایی از نوع نرمال است در حالیکه بازده جریان کاتد بسیار ضعیف بود و نشان دهنده این است که احیای هیدروژن فرایند غالب است. با افزایش دانسیته جريان، مقدار فلز گروه آهن در آلیاژها به سرعت کاهش می یابد و متعاقبا بازده جریان به طور معنی داری افزایش می یابد. دانسیته جریانی که در آن ترسیب الکتروشیمیایی آلیاژ از یک حالت عادی به یک نوع غیر طبیعی تغییر می کند، دانسیته جریان گذار نامیده می شود [7]. افزایش بیشتر دانسیته جریان منجر به تغییر کمی در ترکیب آلیاژ می شود، به دنبال این روند محتوای فلزی گروه آهن به تدریج افزایش پیدا کرده تا جایی که در دانسیته جریانهای بالاتر به خط CRL می رسد. رفتار ترسیب آلیاژ در دانسیته جریان های بالاتر از دانسیته جريان گذار بعدا در ارتباط با ترسیب دوتایی غیر طبیعی Ni با Zn شرح داده خواهد شد.
سپس آلیاژها تحت شرایط مشابه با مطالعه نشان داده شده در شکل 3 ترسیب داده شدند و pH در لایه کاتدی(در موقعیت دقیقا 10 میکرومتری از کاتد) بصورت همزمان با استفاده از روش میکروالکترودهای Sb اندازه گیری شد [33]. نتایج حاصل در شکل 4 خلاصه شده است که در آن رابطه بین ترکیب آلیاژ و pH در مجاورت کاتد آورده شده است. این شکل همچنین شامل CRL، pH محلول بالک و مقادیر بحرانی pH برای هر هیدروکسید فلزی است که با اندازه گیری انحلال پذیری آنها در PH های مختلف در حمام مورد استفاده تعیین شده اند.
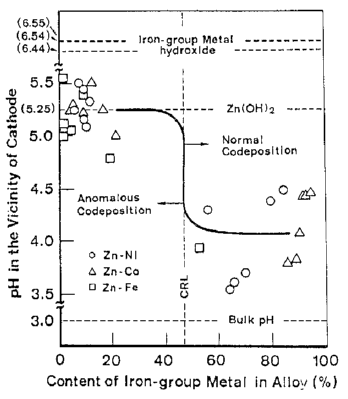
شکل 4: رابطه بین ترکیب آلیاژها و pH در مجاورت کاتد در طول موقعیت الکترود آلیاژهای فلزی آهن-Zn.
شکل 4 نشان داد که pH بحرانی برای رسوب هیدروکسید Zn در منطقه ترسیب دوتایی نرمال بدست نمی آید، اگر چه افزایش pH در لایه کاتد در مقایسه با محلول بالک تا حدودی مشاهده شد. از سوی دیگر، زمانیکه انتقال ترسیب دوتایی از حالت نرمال به نوع غیر طبیعی رخ می دهد، افزایش ناگهانی PH منجر به ترسیب هیدروکسید زینک می شود. در منطقه ترسیب دوتایی غیر طبیعی، pH لایه کاتد در مقادیری نزیک به pH بحرانی برای رسوب هیدروکسید Zn باقی می ماند که بسیار پایین تر از pH بحرانی برای هیدروکسید های فلزات گروه آهن می باشد.
2-3-2. مکانیسم انتقال ناگهانی از یک رسوب نوع معمولی به حالت غیر طبیعی در دانسیته جریان گذار.
در حمام سولفاتی مورد استفاده، یون هایی که قادرهستند در کاتد احیا شوند، هیدروژن، فلزات گروه آهن و Zn هستند و در ساده ترین شکل یون های هیدراته خود حضور دارند. از این یونها، همانطور که قبلا ذکر شد، Zn، مانند بسیاری از فلزات دیگر، در پتانسیل تعادلی خود شروع به ترسیب می کند، در حالی که فلزات گروه آهن و هیدروژن دارای خصوصیات ذاتی هستند که نمی توانند در پتانسیل تعادل خود ترسیب شوند، بلکه به یک اورپتانسیل نیاز دارند.
همانطور که در 2-3-1 توضیح داد شد، رسوب آلیاژی نوع معمولی با بازده جریان بسیار ضعیف در دانسیته جریانهای پایین تر از دانسیته جریان گذار اتفاق می افتد، در حالیکه ترسیب آلیاژ غیر طبیعی با بازده جریان نسبتا بالا پس از رسیدن دانسیته جریان گذار به دست می آید.
در منطقه دانسیته جريان پايين، هر يون قابل ترسیبی در فرم يوني در لايه كاتدی وجود دارد زيرا pH بحراني براي رسوب هيدروكسيد Zn و همچنين هيدروكسيد فلزات گروه آهن به دست نمي آيد (شكل 4). از آنجایی که پلاریزاسیون پتانسیل تعادل ظاهری هیدروژن و فلزات گروه آهن حتی با وجود پلاریزاسیون ذاتی که دارند به حدی نیست که بیش از پتانسیل تعادلی Zn باشد، لذا ترسیب ناچیز هیدروژن و فلزات گروه آهن باید مستقیما مربوط به رفتارهای ترسیب آنها در طی رسوب همزمان باشد. بنابراین، درحالت عادی احیای هیدروژن به عنوان نجیب ترین گونه ترجیح داده می شود و پس از آن به میزان کمی فلزات گروه آهن می باشند، که دلیل اصلی پایین بودن بازده جریان برای رسوب آلیاژی از نوع نرمال است.
با افزایش دانسیته جریان، pH در لایه کاتد به علت افزایش سرعت احیای هیدروژن که منجر به تشکیل هیدروکسید Zn و جذب آن در کاتد می شود در حالیکه در این pH فلزات گروه آهن در لایه کاتدی به دلیل بافری شدن محلول بواسطه هیدرولیز Zn در pH زیر pH بحرانی برای رسوب این هیدروکسید های فلزی به صورت یونی باقی می مانند. سپس، پتانسیلهای تعادل ظاهری هیدروژن و فلزات گروه آهن که پتانسیلهای ترسیب آنها به طور ذاتی تحت تاثیر جذب مواد خارجی قرار می گیرد، بیشتر قطبی می شوند و نیرو محرکه برای رسوب آنها به طور قابل توجهی کاهش می یابد. هنگامی که الکترولیز تحت شرایط گالوانوستاتیک انجام می شود، این شرایط منجر به پلاریزاسیون ناگهانی کاتد در دانسیته جریان گذار به سمت پتانسیل رسوب یون بعدی که همان Zn است می شود. از آن جایی که از نظر ترمودینامیکی پتانسیلهای تعادلی برای رسوب Zn از یون هیدراته شده و هیدروکسید آن در pH بحرانی برای رسوب هیدروکسید Zn یکسان است، لذا تغییر پتانسیل تعادلی به دلیل تشکیل هیدروکسید Zn لازم نیست. بنابراین، زمانی که کاتد برای رسیدن به پتانسیل ترسیب آن پلاریزه می شود ترسیب زینک شروع می شود و با شکل گیری هیدروکسید یون ماقبل به راحتی پیش می رود. از آن جایی که پتانسیل تعادل ظاهری فلز گروه آهن لازم است پلاریزه شود تا به بیش از پتانسیل تعادل Zn برسد و احیای هیدروژن توسط اورپتانسیل بزرگ هیدروژن بر روی Zn همراه با پلاریزاسیون بدلیل هیدروکسید Zn جذب شده کاهش بیشتری می یابد، لذا رسوب آلیاژ غیر معمول با بازده جریان بالا حاصل می شود.
در حال حاضر، توضیح پیشنهاد شده بالا توسط نویسندگان به عنوان محتملترین توضیح درنظر گرفته می شود و به عنوان مکانیزم مهار هیدروکسید نامیده می شود [30].
2-3-3. تأثیر ظرفیت بافر یک حمام آبکاری آلیاژی Zn-Ni بر روی دانسیته جریان گذار - تایید مکانیسم مهار هیدروکسید [34].
با توجه به مکانیسم مهار هیدروکسید، دانسیته جریان گذار تقریبا با حداقل مقدار دانسیته جریان مورد نیاز برای احیای هیدروژن که pH لایه کاتد را به مقدار بحرانی برای رسوب هیدروکسید Zn می رساند برابر است، چراکه احیای هیدروژن در دانسیته جریان پایین، جایی که رسوب آلیاژی نوع عادی در آن رخ می دهد غالب است. بنابراین، هر تغییری در شرایط آبکاری که از افزایش pH در لایه کاتد جلوگیری کند، انتقال از حالت رسوب نرمال به رسوب آلیاژ نوع غیر طبیعی را با افزایش دانسیته جریان گذار مشکل می کند.
بنابراین، آلیاژها در دانسیته جریانهای مختلف از چندین حمام که در جدول 4 لیست شده اند ترسیب شدند و دانسیته جریان گذار در هر حمام تعیین شد. دانسیته های جریان گذار در شکل 5 به عنوان تابعی از ظرفیت بافر رسم شدند که بصورت مقدار تئوری هیدروکسید سدیم مورد نیاز برای رسیدن به رسوب هیدروکسید Zn در هر حمام بیان شده است. همانطور که در شکل 5 نشان داده شده است، دانسیته جریان گذار متناسب با افزایش ظرفیت بافر در حمام افزایش می یابد و نشان دهنده درست بودن مکانیسم مهار هیدروکسید است.
گزارش شده است هنگامی که شرايط مناسب احیای بالای فلز در لايه انتشار کاتد است، به عنوان مثال در دماي پايين يا در حمام هایی که غلظت یون فلزی کل در آنها کم است، دانسیته جريان گذار پايين تر است [7]،[30]. همانطور که در شکل 5 نشان داده شده است، با این حال، گذارها تقریبا در همان دانسیته جریان 0.1 A/dm2 برای حمام 10، 15 و 16 که در آنها غلظت کل یون فلز به شدت از یکدیگر متفاوت بود، مشاهده شد.
جدول 4 ترکیب و ظرفیت بافری حمام
|
16 |
15 |
14 |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
|
|
0.05 |
0.1 |
0.9 |
0.7 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
ZnSO4.7H2O |
|
0.05 |
0.1 |
0.1 |
0.3 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
NiSO4.6H2O |
|
0.9 |
0.8 |
- |
- |
- |
- |
- |
- |
- |
0.5 |
0.5 |
- |
- |
- |
- |
- |
Na2SO4 |
|
0.2 |
0.2 |
0.2 |
0.2 |
1.0 |
0.5 |
0.2 |
0.05 |
0.5 |
- |
- |
- |
- |
- |
- |
- |
CH3COONa.3H2O |
|
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
⃰ |
H2SO4 |
|
3.0 |
3.0 |
3.0 |
3.0 |
3.0 |
3.0 |
3.0 |
3.0 |
2.0 |
2.0 |
1.0 |
3.0 |
2.5 |
2.0 |
1.5 |
1.0 |
pH |
|
47.3 |
47.3 |
89.0 |
67.7 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
47.3 |
Metal- %Ni bath |
|
0.1 |
0.2 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
Total metal Ion Conc. |
|
0.294 |
0.292 |
0.292 |
0.287 |
1.04 |
0.568 |
0.284 |
0.141 |
1.29 |
0.998 |
2.67 |
0.094 |
0.271 |
0.670 |
1.27 |
1.84 |
Bufer capacity |
کلیه غلظت ها بر اساس مول هستند، ⃰ مقدار لازم برای تنظیم pH
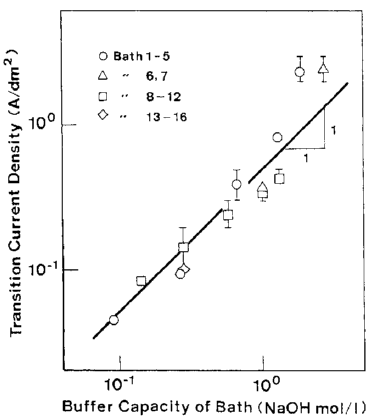
شکل 5: ارتباط بین دانسیته جریان انتقال و ظرفیت بافری حمام
از آنجایی که یون های فلزی معمولا به صورت سولفات فلزی به حمام سولفاتی اضافه می شوند، غلظت یون سولفات که غالبا به عنوان یک عامل بافر کننده عمل می کند در حمام های با غلظت کل یون فلزی پایین کمتر است، مگر اینکه از منبع دیگری به حمام سولفات اضافه شود. بنابراین کاهش غلظت کل یون فلز باعث کاهش ظرفیت بافر در حمام می شود. علاوه بر این، کاهش درجه حرارت باعث کاهش نرخ انتشار یون هیدروژن به کاتد می شود. در نتیجه، نتیجه گیری می شود که دانسیته جریان گذار با تغییرات شرایط آبکاری کاهش می یابد که منجر به احیای یون هیدروژن در لایه کاتد می شود.
2-4. رفتار ترسیب آلیاژهای Zn-Ni از حمام های سولفاتی و توضیح آن بر اساس مکانیسم مهار هیدروکسید [34].
آلیاژها بر روی یک کاتد مسی 2 سانتی متر در 2 سانتیمتر تحت شرایط کولستاتیک (10 C/cm ) و شرایط گالوانوستاتیکی در دمای 313 درجه کلوین (40 درجه سانتیگراد) از حمامهای ساکن (شماره 10، 13-16 در جدول 4) ترسیب داده شدند که در آنها میزان فلز نیکل یا غلظت کل یون فلز متغیر بود، در حالی که ظرفیت بافر تقریبا ثابت نگاه داشته شد بود.
شکل 6 اثر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای رسوب آلیاژ از حمام 10 را نشان می دهد که در کار قبلی ما به عنوان یک حمام استاندارد مورد استفاده قرار گرفت [32]. شکل 6 همچنین بطور همزمان شامل منحنی اندازه گیری شده پلاریزاسیون در طول زمان رسوب آلیاژ است. شکل 7 و 8 رابطه مشابهی را نشان می دهند که در شکل 6 در حمام هایی با فلزات مختلف نیکل (حمام 13، 14) و در حمام ها دارای غلظت متفاوت یون فلزی کل است (حمام 15، 16).
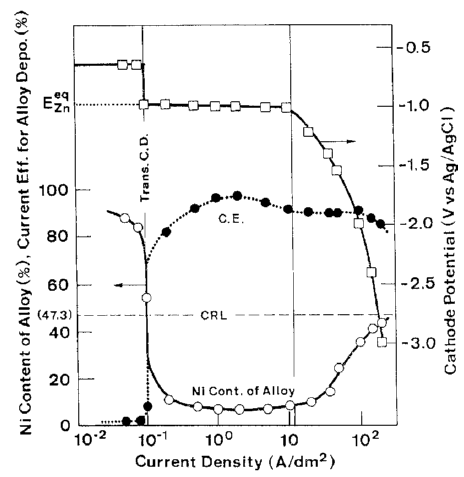
شکل 6: اثر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان و منحنی پلاریزاسیون درطول ترسیب آلیاژ از حمام 10
تغییرات در ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ همان روند را نشان می دهد که در شکل 3 دیده شد، اگرچه رفتار ترسیب آلیاژ در دانسیته جریانهای بالاتر با جزئیات بیشتر تبیین شده است.
با توجه به شکلهای 6، 7 و 8، به طور کلی رفتار ترسیب آلیاژ با توجه به دانسیته جریان همانطور که بصورت شماتیک در شکل 9 نشان داده شده است می تواند به چهار بخش زیر تقسیم شود: منطقه I که در آن دانسیته جريان کم است و در این منطقه ترسیب آلیاژ از نوع عادی با بازده جریان پایین اتفاق می افتد؛ منطقه II که در آن ترسیب آلیاژ با ترکیب درصد فلز کمتر نجیب Zn با بازده جریان بالاتر بطور قابل ملاحظه ای در اولویت است و در این منطقه ترکیب آلیاژ به سختی تغییر می کند؛ منطقه III که در آن مقدار نیکل آلیاژها با افزایش دانسیته جریان افزایش می یابد در حالیکه بازده جریان نسبتا بالا برای رسوب آلیاژ همچنان حفظ می شود؛ و منطقه IV که در آن محتوای نیکل بیشتر به سمت CRL افزایش می یابد در حالی که بازده جریان برای رسوب آلیاژ به طور ناگهانی کاهش می یابد.
رفتار ترسیب آلیاژ در منطقه I و انتقال آن به منطقه II پیش از این در 2-3-2 توضیح داده شده است. رابطه بین دانسیته جريان کل و دانسیته جريانهای جزئي برای رسوب هر فلز و احیای هيدروژن در شکل 10 نشان داده شده است که نتايج آن به عنوان مثال براي حمام هاي 10 و 15 ارائه شده است. با استفاده از این شکل، توضیح رفتار ترسیب آلیاژ در مناطق II، III و IV در زیر آمده است.
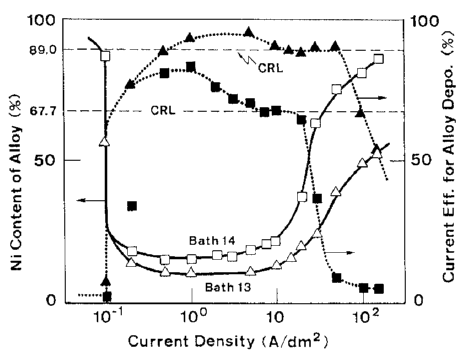
شکل 7: تاثیر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ از حمام های حاوی % مقادیر مختلفی از فلز نیکل
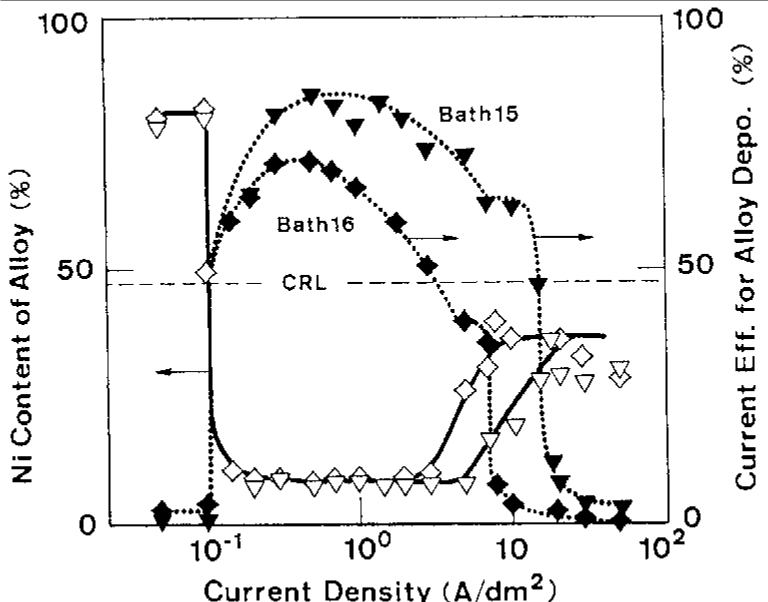
شکل 8: اثر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ از حمام حاوی مقادیر مختلفی از غلظت کل یون فلزی (حمام 15 و 16)
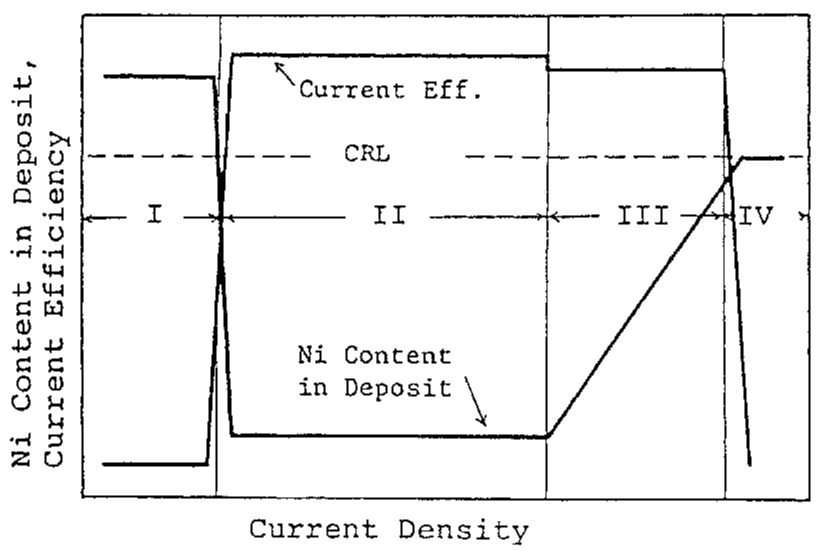
شکل 9 نمایش شماتیک رفتار پوشش آلیاژ
در ناحیه ترسیب دوتایی غیر طبیعی II، رسوب Zn از هیدروکسید آن حاصل می شود و نجیبتر از نیکل یا هیدروژن رفتار می کند. احیای نیکل و هیدروژن، همانطور که قبلا توضیح داده شد، به شدت تحت تأثیر حضور هیدروکسید Zn قرار دارد که وجود آن بستگی به میزان نسبی تشکیل شیمیایی و مصرف الکتروشیمیایی آن دارد. میزان تشکیل شیمیایی هیدروکسید Zn با فعالیت های هر دو یون OH و Zn بر روی کاتد تعیین می شود.
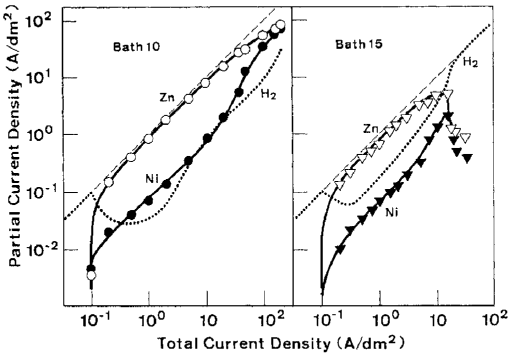
شکل 10: ارتباط بین دانسیته جریان کل و داسیته های جریان جزئی برای ترسیب هر فلز و احیای هیدروژن در حمام های 10 و 15
با توجه به اینکه ثابت نرخ تبدیل هیدروکسید به اندازه کافی بزرگ است، تا زمانی که یون های Zn کافی از محلول بالک تامین شوند و هیچ رسوبی از Zn تحت کنترل انتشار آغاز نشود میزان تشکیل هیدروکسید Zn توسط یونهای OH تولید شده توسط احیای هیدروکسید Zn و همچنین هیدروژن در کاتد تعیین می شود. از سوی دیگر، سرعت مصرف الکتروشیمیایی هیدروکسید Zn دقیقا برابر با جریان ترسیب Zn است. همانطور که سرعت تشکیل یون OH پس از گذار افزایش می یابد، سرعت تشکیل هیدروکسید Zn همیشه بالاتر از مصرف است و منجر به وجود هیدروکسید کاهش نیافته مازاد می شود. در حضور یک مقدار کافی از هیدروکسید Zn جذب شده، و پس از آن، ترسیب آلیاژ نوع غیر طبیعی به راحتی در پتانسیلی که کمی از پتانسیل تعادل Zn نشان داده شده در شکل 6 کمتر نجیب است رخ می دهد. در این منطقه، همانطور که در شکل 10 نشان داده شده است، دانسیته جریان جزئی Zn برای اغلب دانسیته جریان کل محاسبه می شود. دانسیته جریان جزیی نیکل حدود یک دهم دانسیته جریان کل است که نشان دهنده بازده جریان تقریبا ثابت 10٪ است. به عنوان مثال، تغییر بازده جریان جزئی Zn از 85 به 70 درصد، منجر به تغییر کمی در مقدار نیکل آلیاژ از 9.7 به 11.4 درصد می شود. بنابراین ترکیب آلیاژی در این منطقه به ندرت در حال تغییر است.
همانطور که در شکل 10 نشان داده شده است، با افزایش بیشتر دانسیته جریان، بدلیل اینکه Zn در ناحیه ترسیب دوتایی غیر طبیعی به عنوان فلز نجیبتر رفتار می کند، ترسیب Zn تا رسیدن به جریان حد خود بعنوان رسوب ارجح نسبت به Ni شروع می شود. هنگامی که ترسیب Zn شروع به رسیدن به جریان حد خود در منطقه III می کند، سرعت تشکیل شیمیایی هیدروکسید Zn به دلیل کاهش غلظت یون های Zn در کاتد کاهش می یابد، در حالی که سرعت مصرف الکتروشیمیایی به تدریج به سمت جریان حد Zn افزایش می یابد. بنابراین با افزایش دانسیته جریان، مقدار هیدروکسید Zn جذب شده به تدریج کاهش می یابد و منجر به دپلاریزاسیون تدریجی پتانسیل تعادلی ظاهری نیکل و هیدروژن می شود. علاوه بر این، همانطور که در شکل 6 نشان داده شده است، کاتد به علت پلاریزاسون غلظت رسوب Zn بیشتر قطبیده می شود. این مسئله منجر به افزایش نیروی محرکه برای رسوب هیدروژن و همچنین نیکل می شود. در این منطقه، همانطور که در شکل 10 نشان داده شده است، رسوب نیکل نسبت به احیای هیدروژن در اولویت است، که منجر به افزایش میزان نیکل آلیاژها نسبت به CRL و بازده جریان نسبتا بالا و ثابت برای رسوب آلیاژ می شود. با توجه به این بحث، منطقه III، و از این رو، بخش رو به رشد منحنی محتوای Ni در شکل 9، باید با کاهش مقدار غلظت یون Zn در حمام به سمت چپ جابجا شود. چراکه جریان حد برای رسوب Zn در دانسیته جریان پایین تر در حمامهای با غلظت یون Zn کمتر به دست می آید. این موضوع در شکل 6، 7 و 8 نشان داده شده است.
در منطقه IV جایی که جریان حد برای رسوب Zn تقریبا به دست می آید (شکل 10)، هیدروکسید Zn جذب شده تا حد زیادی کاهش می یابد که اجازه می دهد تا دپلاریزاسیون پتانسیل تعادلی ظاهری هیدروژن به سطح اولیه آن برسد. بنابراین، احیای هیدروژن بعنوان پدیده غالب باعث کاهش قابل ملاحظه ای در بازده جریان ترسیب آلیاژ می شود. علاوه بر این، همچنان که ثابت شد با کاهش ناگهانی جریان های ترسیب هر دو فلز در دانسیته جریانهای بالا ( حمام 15 در شکل 10)، رسوبات پودری شده و از سطح کاتد فرو میریزند. این مسئله همچنین به کاهش بازده جریان برای ترسیب آلیاژ کمک کرده است.
2-5. چندین نتایج تجربی نشان دهنده نقش فلزات گروه آهن در ترسیب آلیاژ نوع غیر طبیعی است.
2-5-1 رسوب آلیاژ Zn-Cd از حمام سولفاتی [35].
اگر فرض شود که خصوصیات فلز گروه آهن که در 2-2 توضیح داده شد، دلیل اصلی ظهور رسوب غیر طبیعی آلیاژ Zn با فلزات گروه آهن نمی باشد، اما احتمال افزایش ترسیب دوتایی غیر طبیعی وجود دارد همچنین ممکن است در رسوبات همزمان Zn با سایر فلزاتی که نجیب تر از Zn هستند و در یک pH بالاتر هیدرولیز می شوند اتفاق بیفتد. به عنوان یک مثال برای چنین فلزی، ما می توانیم Cd را پیدا کنیم که پتانسیل الکترود استاندارد و pH بحرانی آن برای تشکیل هیدروکسید با Fe قابل مقایسه است. در طول ترسیب آلیاژ Zn-Cd، Cd باید از یون هیدراته شده خودش در حضور هیدروکسید Zn جذب شده در کاتد رسوب کند.
جدول 5 شرایط استاندارد آبکاری برای آلیاژهای Zn-Cd.
|
Operating condition |
Bath composition |
||
|
500 A/m2 |
Current density |
0.92 mol/1 (60 g/l as Zn) |
Zn sulfate |
|
40 oC |
Temperature |
0.018 mol/l (2 g/l as Cd) |
Cd sulfate |
|
300 kC/m |
Amount of charge |
0.1 g/1 |
Glue |
|
Quiescent bath |
⃰ |
Sulfuric acid |
|
ضروری است که pH محلول در 3 تنظیم شود
آلیاژها تحت شرایط نشان داده شده در جدول 5 از حمام سولفاتی بدست آمدند. تاثیرات ترکیب حمام و دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای رسوب آلیاژ در شکلهای 11 و 12 نشان داده شده است. از این شکلها می توان دریافت که در شرایط مورد مطالعه، ترسیب آلیاژ از نوع عادی بوده است. منحنی قطبش جزئی برای رسوب هر فلز با استفاده از حمامهای حاوی Zn و یا Cd اندازه گیری شد. هر یک از حمامهای حاوی تک فلزی با حذف فلز دیگر از حمام آبکاری آلیاژ تهیه شد. نتایج در شکل 13 نشان داده شده است. شکل 14 همچنین تغییرات در ترکیب آلیاژ و بازده جریان بدست آمده از شکل 12 را نشان می دهد. همان طور که در شکل 13 نشان داده شده است، منحنی قطبش جزئی برای رسوب هر فلز از یک حمام آبکاری آلیاژی در تطابق خوبی با آنچیزی است که از حمام تک فلزی متناظر آن حاصل می شود. Cd بعنوان فلز نجیبتر در پتانسیل تعادل خود شروع به ترسیب کرد و سرعت ترسیب Cd به سرعت به جریان حد خود می رسد. هنگامی که کاتد نسبت به پتانسیل تعادلی Zn تحت انتشار کنترل شده Cd پلاریزه شد، ترسیب Zn آغاز شد. بنابراین رسوب این آلیاژ با در اولویت بودن ترسیب Cd بعنوان فلز نجیب تر در پتانسیل های نجیب رفتار نوع معمولی را بروز می دهد و همچنین کاهش سریع محتوای Cd آلیاژها به سمت CRL در پتانسیل های کمتر نجیب را نشان می دهد جایی که Zn نیز در آنها ترسیب می شود و با کاهش پتانسیل، سرعت رسوب Zn افزایش می یابد.
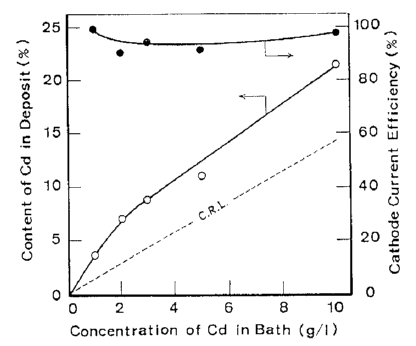
شکل 11 تاثیر غلظت Cd در حمام بر روی ترکیب آلیاژ و بازده جریان کاتد برای ترسیب آلیاژ
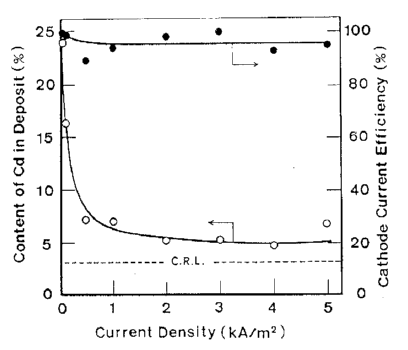
شکل 12 تاثیر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان کاتدی برای ترسیب آلیاژ
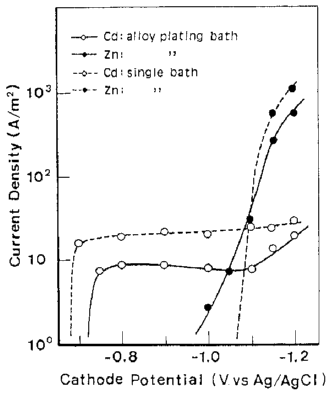
شکل 13 منحنی پلاریزاسیون جزئی برای ترسیب Zn و Cd از حمام آبکاری آلیاژی و حمام تک فلزی آنها
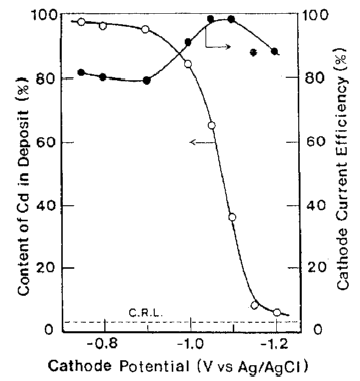
شکل 14 تاثیر پتانسیل کاتد بر روی ترکیب آلیاژ و بر روی بازده جریان کاتدی برای ترسیب آلیاژ
همانطور که در بالا گفته شد، هیچ رسوب آلیاژی غیر طبیعی در سیستم Zn-Cd مشاهده نشد. این نشان می دهد که خصوصیات متمایز فلزات گروه آهن که در 2-2 شرح داده شده است، برای ظهور رسوب الکتریکی غیرطبیعی فلزات گروه آهن با Zn ضروری است.
2-5-2. رسوب آلیاژ Cd-Ni از یک حمام سولفات [36].
رسوب آلیاژ Cd-Ni یکی از بهترین نمونه های شناخته شده ترسیب دوتایی غیر طبیعی است که در آن از نظر الکتروشیمیایی ترسیب Cd بعنوان فلز کمتر نجیب در اولویت است. با این حال، در این مورد، بدلیل اینکه pH بحرانی برای هیدروکسید فلزی در نیکل کمتر از Cd است نمیتوان انتظار تشکیل هیدروکسید فلز کمتر نجیب را داشت.
منحنی های پتانسیل کاتدی-دانسیته جریان جزئی برای ترسیب هر فلزی از حمام های حاوی Ni و / یا Cd در شکل های 15، 16 و 17 نشان داده شده است. حمام آبکاری آلیاژی حاوی 0.9 مول بر لیتر نیکل سولفات، 0.1 مول بر لیتر کادمیوم سولفات، 0.2 مول بر لیتر سدیم استات و مقداری سولفوریک اسید لازم برای تنظیم pH محلول تا 3 است. حمام تک فلزی با حذف Ni یا Cd از حمام آبکاری آلیاژی تهیه شد. اندازه گیری در یک حمام غیر متلاطم با دمای 30 درجه سانتیگراد انجام شد.
رسوب Cd از حمام تک فلزی مربوطه در پتانسیل تعادل خود (-0.65 V در مقابل Ag/AgCl ) آغاز شد و سرعت رسوب آن تقریبا بلافاصله به جریان حد خود افزایش یافت. این روند تقریبا مشابه ترسیب Cd از حمام آبکاری آلیاژی بود. از سوی دیگر، Ni از حمام تک فلزی مربوطه خود در پتانسیلی که به میزان قابل توجهی از پتانسیل تعادلی خودش کمتر نجیب بود شروع به ترسیب شدن کرد (-0.23 V در مقابل Ag/AgCl ) و سرعت رسوب آن به تدریج به جریان حد افزایش یافت. این روند تقریبا همانند روند حمام آبکاری آلیاژی است. این نشان می دهد که پتانسیل ترسیب قطبیده شده Ni در حمام آبکاری آلیاژی، که تقریبا قابل مقایسه با پتانسیل ترسیب Cd است، ناشی از برهم کنش با Cd نیست.
بنابراين مي توان نتيجه گيري کرد که اولویت داشتن ترسیب Cd فقط ناشی از اور پتانسیل ذاتی ترسیب Ni است که در 2-2 توضیح داده شد. شکل 18، وابستگی بالقوه ترکیب واقعی آلیاژ را همراه با مقدار محاسبه شده در شکل های 15 و 16 نشان می دهد. روند هر دو منحنی به خوبی در انطباق باهم هستند، که نشان دهنده اعتبار بحث فوق است.
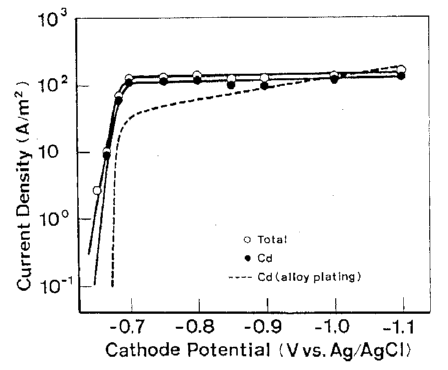
شکل 15 منحنی پلاریزاسیون در ترسیب منفرد Cd
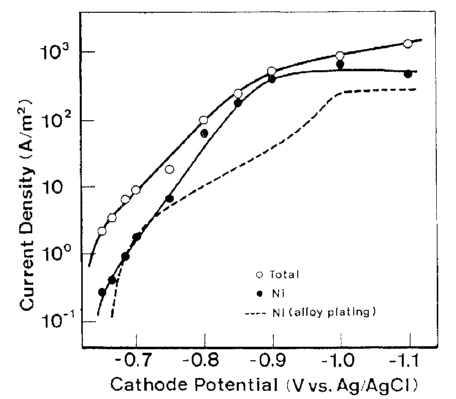
شکل 16 منحنی های پلاریزاسیون در ترسیب Ni منفرد
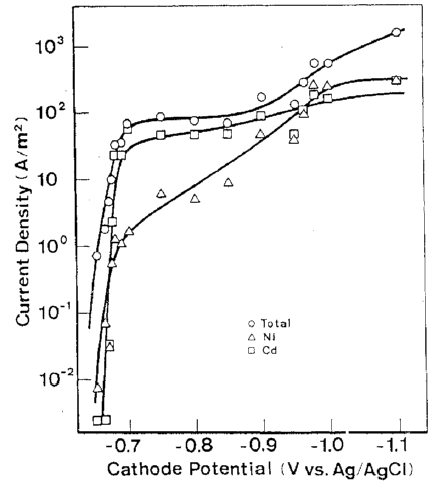
منحنی های پلاریزاسیون در ترسیب آلیاژ Ni-Cd
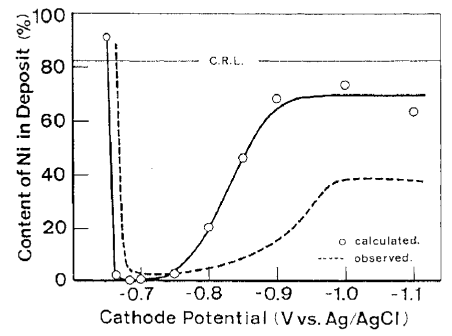
شکل 18 ترکیب محاسبه شده آلیاژ ، با فرض اینکه سرعت ترسیب آلیاژ بصورت جمع سرعتهای ترسیب منفرد هریک از اجزای Ni و Cd بیان می شود
2-5-3. عوامل تعیین مکانیزم رسوب آلیاژ غیر طبیعی.
همانطور که تاکنون توضیح داده شد، خواص فلزات گروه آهن در حالت یونی نقش مهمی در رسوب آلیاژ غیر طبیعی ایفا می کند. در ترسیب آلیاژ Cd-Ni، همانطور که در 2-5-2 نشان داده شده است، اور پتانسیل ذاتی بزرگ ترسیب Ni، مسئول اصلی رسوب آلیاژ دوتایی غیر طبیعی است. از سوی دیگر در ترسیب Zn با فلزات گروه آهن، مهار کنندهای مانند هیدروکسید Zn که موجب قطبش اضافی فلزات گروه آهن شد، لازم بود. با تلفیق فاکتور الکتروشیمیایی پتانسیل الکترود تنهای هر فلز با فاکتور شیمیایی pH بحرانی برای هر هیدروکسید فلزی، می توان برآورد کرد که کدام یک از دو نوع ترسیب دوتایی غیر طبیعی فوق در هر یک سیستمهای آلیاژی اتفاق خواهد افتاد.
جدول 6 پتانسیل الکترودهای استاندارد [8] فلزات گروه آهن و دیگر فلزات را که از فلز گروه آهن کمتر نجیب (فعالتر) هستند و از اینرو می توانند از یون های هیدراته شده با بازده جریان بالا ترسیب داد شوند را نشان می دهد[9]. جدول 6 همچنین pH بحرانی را برای ترسیب هر هیدروکسید فلزی از محلول حاوی 1 مول بر لیتر هر یون فلزی نشان می دهد [8]. در ترسیب الکتریکی آلیاژهای Cd-Ni و Cd-Co، قطبش فلز گروه آهن به علت هیدروکسید Cd جذب شده قابل انتظار نیست چون وقتی PH در لایه کاتد افزایش می یابد تشکیل هیدروکسید فلز گروه آهن نسبت به هیدروکسید Cd در اولویت است. با این حال، در این مورد، تفاوت در پتانسیلهای الکترود تنها در هر دو جزء نسبتا کوچک است (0.13 و 0.15V)، و برتری فلزات گروه آهن نسبت به Cd در نجیب تر بودن تنها می تواند از طریق اورپتانسیل ذاتی فلزات گروه آهن لغو شود. از سوی دیگر، در ترسیب الکتریکی آلیاژهای فلزات گروه آهن با Zn، تفاوت در پتانسیل الکترودهای تنها بین هر دو جزء 0.32 تا 0.51 V است که به نظر می رسد بیش از حد بزرگ باشد که بخواهد صرفا بدلیل اورپتانسیل ذاتی ترسیب فلزات گروه آهن منتفی شود. با این حال، در این مورد، هیدروکسید Zn در pH پایین تری از هیدروکسید های فلزات گروه آهن تشکیل می شود. بنابراین، رسوب فلز گروه آهن توسط هیدروکسید Zn جذب شده بیشتر قطبیده می شود، که منجر به از بین بردن برتري فلزات گروه آهن در نجیب تر (غیر فعالتر) بودن الکتروشیمیایی می شود.
جدول 6 عوامل الکتروشیمیایی و شیمیایی تأثیرگذار بر وقوع رسوب دوتایی غیرطبیعی در سیستم ترکیبی فلزات گروه آهن نجیب تر با سایر فلزات کمتر نجیب
|
Mn |
Zn |
Cd |
Fe |
Co |
Ni |
element |
|
-1.179 |
-0.763 |
-0.403 |
-0.440 |
-0.277 |
-0.25 |
E°(V vs NHE) |
|
7.655 |
5.48 |
6.905 |
6.645 |
6.30 |
6.09 |
pHcri(calculated at 1 mol/1) |
|
5.25 |
7.41 |
6.44 |
6.54 |
6.55 |
pHcri(determined in the bath used) |
علاوه بر این، اجازه دهید الکترولیز محلول حاوی فلزات گروه آهن و منگنز را در نظر بگیریم. در این مورد، تفاوت در پتانسیل الکترودهای تنها بین هر دو جزء بسیار زیاد است (0.74 - 0.93 ولت) و هیچ هیدروکسید منگنزی تشکیل نمی شود. بنابراین، رسوب آلیاژ به ندرت از محلول حاوی این یونهای هیدراته شده رخ می دهد. یک عامل کمپلکس دهنده مانند پیرو فسفریک اسید برای ترسیب این آلیاژ مورد نیاز است [37].
2-5-4. ترسیب Zn با Ni در پتانسیلی کمتر از پتانسیل تعادل هر یک از اجزا
همان طور که در شکل 6 نشان داده شده است، مقادیر قابل توجهی از آلیاژهای Zn-Ni در منطقه I که دانسیته پایینی دارد ترسیب می شوند که در آن پتانسیل کاتد از نظر ترمودینامیکی قطبییده نشده است تا منجر به ترسیب Zn شود. این به این معنی است که رسوب Zn در پتانسیل هایی که نجیبتر از مقدار پتانسیل تعادلی آن هستند اتفاق می افتد. مکانیسمی که اجازه می دهد ترسیب Zn در پتانسیلهای پایین ممکن شود. همانطور که قبلا ذکر شد، در ترسیب غیر طبیعی آلیاژی Zn با فلزات گروه آهن خواص فلز گروه آهن در حالت یونی نقش مهمی را ایفا می کند، اما این خواص در حالت فلزی ممکن است هیچ مشارکتی نداشته باشند. با این حال، این احتمال وجود دارد که خواص فلزات گروه آهن در حالت فلزی ممکن است در رسوب Zn با Ni دخالت داشته باشند، زیرا همانطور که در ادامه توضیح داده می شود، این پدیده ویژگی اصلی ترسیب دوتایی القا شده که در آن خواص در حالت فلزی نقش مهمی ایفا می کند را نشان می دهد.
جدول 7 شرایط تجربی مورد استفاده را نشان می دهد. غلظت بسیار پایین Zn در حمام، در مقایسه با فلز گروه آهن، به منظور ترسیب دوتایی Zn تا حد امکان در نظر گرفته شد. دمای فرایند در بازه وسیعی از 5 تا 80 درجه سانتی گراد متغیر بود زیرا اورپتانسیل ترسیب فلزات گروه آهن به شدت به دما بستگی دارد و تقریبا در دمای بالا ناپدید می شود [10]. اگر چه آزمایشات با همه فلزات گروه آهن و Zn انجام شده است، اما فقط نتایج مربوط به سیستم Zn-Ni در اینجا آورده شده است، زیرا نتایج در کلیه سیستمهای آلیاژی روند مشابهی را نشان می دادند.
جدول 7 شرایط تجربی برای مطالعه ترسیب در زیر پتانسیل Zn همراه با فلزات گروه آهن
|
Operating condition |
Bath composition |
||
|
-0.6 — -1.37 vs Ag/AgCl |
Catod Potential |
0.025 mol/1 |
Zn sulfate |
|
5-80 oC |
Temperature |
0.5 mol/l |
Iron group metal sulfate |
|
100 kC/m2 |
Amount of charge |
⃰ |
Sulfuric acid |
|
Quiescent bath |
|||
⃰ مقدار لازم جهت تنظیم pH در 3.0
شکل 19 منحنی پلاریزاسیون جزئی را برای ترسیب هر فلز از حمام تک فلزی مربوطه در دماهای مختلف را نشان می دهد. در تمام دماهای مورد مطالعه، ترسیب Zn در پتاسیل تعادلی خودش آغاز شد، اگرچه جریان حد برای ترسیب Zn با افزایش دما افزایش یافت. از سوی دیگر، در ترسیب نیکل، پتانسیل ترسیب که در 5 درجه سانتیگراد به شدت قطبی شده بود، در حدود 80 درجه سانتیگراد تقریبا به مقدار تعادلی خود بازگشت.
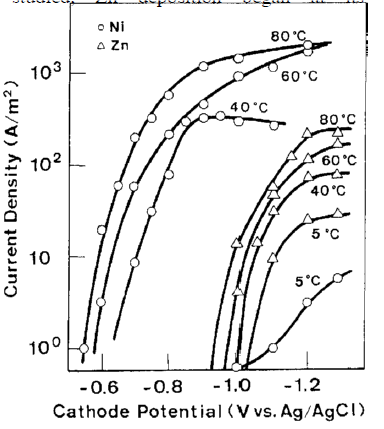
شکل 19 تاثیر دمای حمام بر روی منحنی های پلاریزاسیون Ni و Zn از محلولهای تک فلزی آنها
آلیاژهای Zn-Ni در دو درجه حرارت متفاوت، 40 و 80 درجه سانتیگراد بصورت الکتریکی ترسیب داده شدند. در دمای 40
درجه سانتیگراد، Ni همچنان اورپتانسیل ذاتی ترسیب قابل توجهی را نشان داد اما در دمای 80 درجه سانتیگراد، این اورپتانسیل ذاتی تقریبا ناپدید شد. مقایسه بین دانسیته جریانهای جزئی برای رسوب هر فلز از حمام تک فلزی مربوطه و همینطور از حمام آبکاری آلیاژی، در شکل های 20 و 21 به ترتیب در دماهای 40 و 80 درجه سانتیگراد نشان داده شده است.
با توجه به شکل 20، ترسیب نیکل به طور قابل ملاحظه ای در حمام آبکاری آلیاژی دچار افت شد، که این شکل به سادگی ویژگی اصلی ترسیب دوتایی غیر طبیعی را نشان داد. از سوی دیگر، رسوب Zn از حمام آبکاری آلیاژی در پتانسیلهای نجیبی که عموما هیچ رسوب Zn ای از حمام تک فلزی مربوطه امکان ترسیب ندارد رخ داده است. در نتیجه یک کاهش پتانسیل ترسیب برای Zn هنگام رسوب آلیاژ مشاهده شد. در 80 درجه سانتیگراد که در آن اورپتانسیل ذاتی ترسیب فلزات گروه آهن تقریبا ناپدید شد، نیکل در همان پتانسیلی که در حمام تک فلزی خود احیا می شود از حمام آبکاری آلیاژی شروع به احیاء شدن کرد و در این دما جریان برای کاهش پتانسیل ترسیب Zn شدیدا افزایش یافت.
همانطور که در شکل 22 نشان داده شده است، آنالیز طیف سنج الکترونی آگار بدست آمده از رسوبات در پتانسیلهای پایین تر از پتانسیل تعادل (-0.75 V vs. Ag/AgCl) و اورپتانسیل (-1.10 V vs. Ag/AgCl) وجود Zn فلزی را در هر دو رسوب مشخص کرد، و از طرفی هیچ مدرکی مبنی بر اینکه هیدروکسید Zn تشکیل شده در کاتد درون رسوب وارد شده باشد، وجود نداشت.
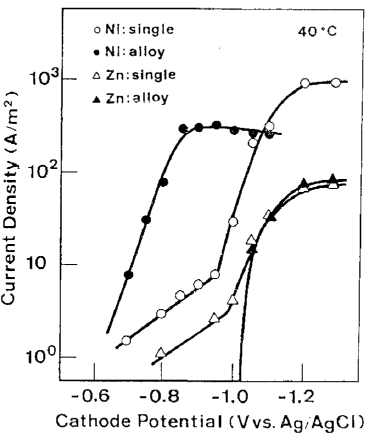
مقایسه بین منحنی های پلاریزاسیون جزئی Ni و Zn در طول آبکاری آلیاژی Zn-Ni و فلزات تنهای آنها در 40 درجه سانتی گراد.
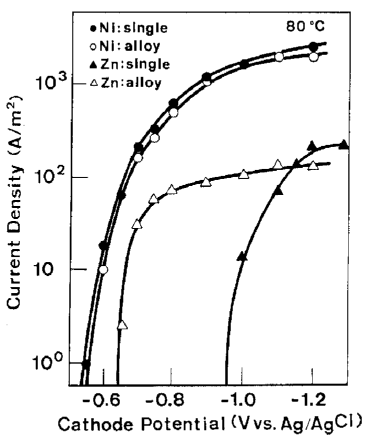
شکل 21 مقایسه بین منحنی های پلاریزاسیون جزئی Ni و Zn در طول آبکاری آلیاژی Zn-Ni و فلزات تنهای آنها در 80 درجه سانتی گراد.
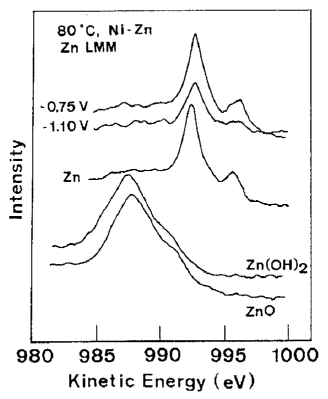
شکل 22 طیف الکترون آگار Zn (فرایند آگار LMM) در فلز خالص Zn(OH) , ZnO, Zn و رسوبات آلیاژی Zn-Ni
علاوه بر این، ترسیب الکتریکی آلیاژهای Zn با سایر فلزات در ارتباط با ترسیب Zn در پتانسیلی کمتر از پتانسیل تعادل آن مورد بررسی قرار گرفت. شکل 23، منحنی های قطبش جزئی برای احیای Zn از حمام های آبکاری آلیاژی Zn-Cd و Zn-Cu، Zn-Ni و حمام های Zn تنها را مقایسه می کند. بر اساس نتایج بدست آمده مشخص شد که منحنی های قطبش جزئی برای ترسیب Zn از حمام های آبکاری آلیاژی Zn-Cd و Zn-Cu نزدیک به نتایج مربوط به حمام Zn تنها بود.
همانطور که در بالا اشاره شد، احیای Zn در پتانسیل کمتر از پتانسیل تعادل ترسیب Zn تنها در حضور فلزات گروه آهن رخ داد و زمانی میسر شد که شرایط اجازه کاهش در اورپتانسیل ذاتی ترسیب فلزات گروه آهن را برای رسیدن به ترسیب ساده آنها داد. به نظر می رسد این شبیه همان پدیده ای است که بعنوان ترسیب دوتایی القا شده فلزات بی میل (فعال) که در آن خواص فلز گروه آهن در حالت فلزی نقش مهمی در ترسیب الکتریکی آلیاژها با بازده جریان قابل توجه ایفا می کنند [27]. با این حال، در ترسیب آلیاژی نوع القا شده، یون فلزی بی میل (فعال) می تواند به طور منطقی در حضور یک کاتالیزور به حالت فلزی احیا شود، زیرا نیروی محرکه ترمودینامیکی برای احیای آن وجود دارد. از سوی دیگر، احیای Zn در پتانسیلی کمتر از پتانسیل تعادل یون Zn در منطقه پتانسیلی رخ می دهد که هیچ نیروی محرکه ترمودینامیکی وجود ندارد. بنابراین، به نظر می رسد غیرممکن است که مکانیسم ترسیب آلیاژ نوع القا شده را مستقیما توسط اینکه نگاه داشته شدن هیدروژن اتمی بر روی فلز گروه آهن تازه ترسیب شده، باعث کاهش هیدروکسید Zn به Zn فلزی می شود، توضیح داد.
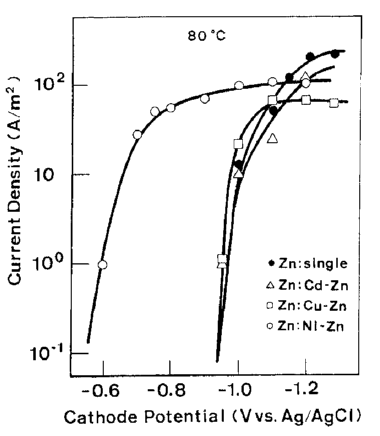
شکل 23 منحنی های پلاریزاسیون Zn در طول آبکاری Zn تنها، Zn, Cd-Zn, Cu-Zn و آلیاژهای Ni-Zn
در ترسیب الکتریکی بعضی فلزات بر روی بسترهای فلزی متفاوت، پتانسیل تعادل فلزی که قرار است رسوب داده شود به به شدت به سمت منطقه مثبت حرکت می کند، زیرا فعالیت فاز فلزی پیش از اینکه شروع به رسوب دادن کند صفر است. در نتیجه، در منطقه پتانسیلی که نجیبتر ازمقدار پتانسیل تعادل محاسبه شده تحت شرایطی که فعالیت فاز فلزی واحد است، ترسیب فلز حتی در یک مقدار بسیار کم باید ممکن باشد تا زمانی که فلز ترسیب یافته فعالیتی مطابق با پتانسیل داده شده نشان دهد. از آنجایی که مقدار فلز ترسیب یافته بسیار کم است لذا باید توسط آنالیز شیمیایی مورد شناسایی قرار بگیرد، عملا هیچ توده رسوب فلزی در منطقه زیر پتانسیل وجود ندارد. اگر ترسیب دوتایی فلز گروه آهن به موقعیتی برسد که اجازه بدهد فعالیت Zn ترسیب شده بطور مداوم بر روی سطح کاتد تشکیل شود تا در مقداری که بیش از مقدار پتانسیل داده شده نباشد نگه داشته شود، از نظر ترمودینامیکی توضیح مقادیر زیادی از رسوب در منطقه زیرپتانسیل که در شکل 21 نشان داده شده است ممکن خواهد شد.
همانطور که در بالا توضیح داده شد، به نظر می رسد خواص فلز گروه آهن در حالت فلزی باعث ترسیب Zn در منطقه زیر پتانسیل میشود، اگر چه این مکانیسم در حال حاضر کاملا مبهم است.
نویسنده این مطلب

محقق واحد پژوهش و گسترش
|
گرد آوری و ترجمه و تدوین : دانش آموخته دکتری شیمی آلی- مهندسی پلیمر دانشگاه شهید مدنی آذربایجان-دانشگاه صنعتی سهند، تبریز- ایران دانش آموخته کارشناسی ارشد شیمی آلی دانشگاه الزهرا (س)-تهران-ایران دانش آموخته کارشناسی شیمی کاربردی دانشگاه تبریز، تبریز- ایران |
Dr. M.J Phd graduated, Organic chemistry- Polymer Engineering Azarbiaijan Shahid Madani University, Tabriz, Iran- Sahand University of Technology, Tabriz, Iran
Alzahra university, Tehran, Iran
Tabriz university, Tabriz, Iran |