مطالعه بنیادین بر روی مقاومت به خوردگی پوشش آلیاژیZn-Ni
مقدمه
خواص مکانیکی و شیمیایی فلزات بطور قابل توجهی توسط آلیاژ کردن بهبود می یابد. در سالهای اخیر، آبکاری آلیاژی علاقه شدیدی را بعنوان یک تکنیک جدید که امکانات صنعتی بسیاری را برای تولید پوشش های با کیفیت بالاتر در حوزه پوشش سطح محصولات هیدرومتالورژیکی و تولید هیدرومتالورژیکی مواد جدیدی همانند ترکیبات فاز جامد ( intermetallic ) محلول های جامد فوق اشباع و آلیاژهای آمورفی که به روش پیرومتالورژیکی قابل دست یابی نیستند در اختیار ما میگذارد.
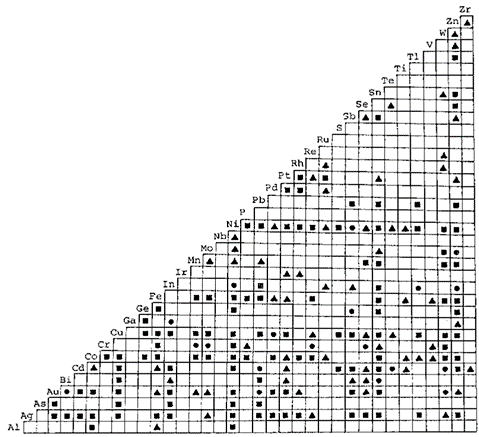
شکل 1 آلیاژهای دوتایی آبکاری شده در محلول های آبی:
■آلیاژهای گزارش شده تا سال 1960 را نشان می دهد.
● آلیاژهایی که برای اولین بار بین سالهای 1961 تا 1964 آبکاری شده اند را نشان می دهد
▲ آلیاژهای گزارش شده از سال 1964 به بعد را نشان می دهد.
آبکاری آلیاژی تاریخچه ای به قدمت 147 سال دارد که اولین باردر سال 1841 جاکوب توانست به روش آبکاری آلیاژ برنج را بدست آورد، و تا به امروز همانگونه که در شکل 1 نیز نشان داده شده است، تلاش های بسیاری صورت گرفته و بیش از 200 نوع آلیاژ دوتایی و سه تایی از محلولهای آبی تهیه شده است. تقریبا 70 نوع از این آلیاژها، بعبارتی چیزی بیش از یک سوم کل آلیاژی که قبلا گزارش شده اند، شامل فلزات گروه آهن هستند. حدود 30 مورد از این سیستمهای آلیاژی مربوط به آلیاژهای نیکل، 23 مورد مربوط به کبالت و 21 مورد نیز آلیاژهای آهن هستند. بنابراین در بین فلزات گروه آهن، نیکل بیشترین تعداد ساختارهای آلیاژی را به خود اختصاص داده است. همانطور که در جدول یک دیده میشود، بررسی تعداد زیادی از مقالات چاپ شده در بین سالهای 1975 و 1984 نشان داد که 80% از این مقالات در مورد سیستمهای آلیاژی فلزات گروه آهن بویژه نیکل هستند. از میان آلیاژهای نیکل، Ni-Zn، Ni-Fe و Ni-Sn سیستمهایی هستند که عمدتا بیشتر مورد بررسی قرار می گیرند، زیرا انتظار می رود که پوشش به دست آمده ویژگی های برجسته مطلوبی برای استفاده عملی داشته باشد و علاوه بر این، رفتار پوشش آنها از نقطه نظر علمی جالب توجه است. شکل 2، روند تعداد گزارش های ارائه شده مربوط به سه سیستم آلیاژی فوق در 12 سال گذشته را به خوبی نشان می دهد. مشخصا در هر سال، مطالعات زیادی در ارتباط با آبکاری سیستم های Ni-Fe و Ni-Sn برای پوشش های تزئینی، مقاوم در برابر خوردگی یا آلیاژهای مغناطیسی انجام شده است. از سوی دیگر، تعداد گزارشات مربوط به آلیاژهای Ni-Zn از اوایل دهه 1980 به طور ناگهانی افزایش یافته است. این روند به طور عمده ناشی از تحقیقات گسترده تولید کنندگان فولاد برای ایجاد ورق فولادی مقاوم در برابر خوردگی برای پانل های بدنه خودرو است [2] - [6]. به منظور ارتقاء کاربرد عملی آلیاژ بسیار مقاوم Ni-Zn در برابر خوردگی در زمینه های دیگر آبکاری فلزی و همچنین در صنعت خودرو، داشتن دانش جامع درمورد پوشش آلیاژی Ni-Zn ضروری می باشد. نویسندگان این مقاله برای انجام یک سری مطالعات در مورد پوشش آلیاژی Zn-Ni تحت حمایت مالی مؤسسه توسعه نیکل قرار گرفته اند. این یک گزارش نهایی است که به موسسه نامبرده ارائه شده است.
|
جدول 1 درصد مواد فلزی مورد استفاده در عناصر آلیاژی. یک نظرسنجی از گزارش های اخیر در مورد رسوب آلیاژ (1975-1984).
|
| |
75
|
76
|
77
|
78
|
79
|
80
|
81
|
82
|
83
|
84
|
|
Ni
|
40.0
|
41.0
|
46.3
|
38.0
|
41.9
|
26.5
|
39.1
|
40.0
|
55.5
|
48.7
|
|
Co
|
23.0
|
19.7
|
20.7
|
35.4
|
30.1
|
18.4
|
16.3
|
16.7
|
10.6
|
15.7
|
|
Fe
|
19.7
|
13.1
|
18.3
|
6.3
|
14.0
|
7.1
|
21.7
|
22.2
|
17.6
|
19.1
|
|
Zn
|
3.3
|
18.0
|
14.6
|
11.4
|
7.5
|
17.3
|
18.5
|
24.4
|
47.1
|
35.7
|
|
Sn
|
24.6
|
27.9
|
12.2
|
20.3
|
17.2
|
20.4
|
13.0
|
24.4
|
12.9
|
13.9
|
|
Cu
|
16.4
|
17.7
|
12.2
|
20.3
|
18.3
|
14.3
|
13.0
|
8.2
|
13.0
|
7.8
|
|
Au
|
13.1
|
18.0
|
12.2
|
10.1
|
18.3
|
14.3
|
14.1
|
14.4
|
5.9
|
8.7
|
|
Pb
|
11.5
|
9.8
|
9.8
|
8.9
|
5.4
|
16.3
|
10.9
|
13.3
|
8.2
|
6.1
|
|
Cr
|
4.9
|
6.6
|
11.0
|
5.1
|
9.7
|
4.1
|
10.9
|
6.7
|
5.9
|
7.0
|
|
Cd
|
3.3
|
14.8
|
9.8
|
6.3
|
6.5
|
7.1
|
6.5
|
5.6
|
3.5
|
7.8
|
|
⃰
|
61
|
61
|
82
|
79
|
93
|
98
|
92
|
90
|
85
|
115
|
⃰ مجموع تعدا گزارشات
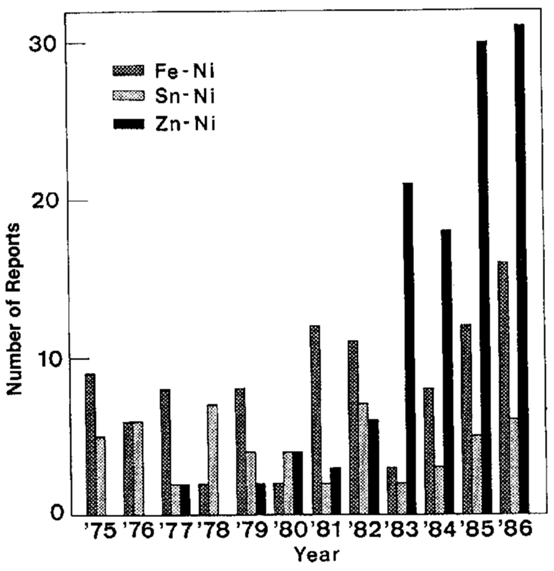
شکل 2 آمار سالیانه گزارشهای مربوط به آلیاژهای Fe-Ni, Sn-Ni و Zn-Ni
2. فرایند بنیادین آبکاری آلیاژهای Zn-Ni.
2-1 ویژگی کلی پوشش غیر عادی آلیاژ
در ترسیب (تخلیه بار الکتریکی) همزمان یون های مختلف فلزی که پتانسیل های تعادلی آنها چندان باهم فرقی ندارند، به طور عمده سهم فلز نجیب تر به علت تمایل بیشتر برای ترسیب، در پوشش بیشتر است. هنگامی که پتانسیل های الکترود تنهای فلزات خیلی باهم متفاوت باشند، بسیار دشوار خواهد بود تا با تغییر نسبت غلظت یونهای فلزی پتانسیل تعادلی آنها را در محلول بهم نزدیک کرد، و تقریبا بعید است که پتانسل تعادل کاتد نسبت به فلز کمتر نجیب پلاریزه شود. بنابراین، امکان پوشش آلیاژی وجو ندارد، مگر اینکه فعالیت یون فلز نجیب در محلول به طور قابل توجهی توسط تشکیل یک کمپکس پایدار کاهش یابد. از سوی دیگر، در ترسیب آلیاژهای فلزات گروه آهن با Zn یا Cd و همچنین آلیاژهای دوفلزی از فلزات گروه آهن مانند Fe-Ni و Fe-Co، این رفتار غیر عادی بعنوان ترسیب ارجح فلز کمتر نجیب حتی در ترسیب همزمان یونهای هیدراته به نظر می رسد. این دسته پوششهای آلیاژی عموما "نوع غیر طبیعی" نامیده می شود [7]. در تمام سیستم های آلیاژی که در بالا ارائه شده است، فلزات گروه آهن لزوما نسبت به سایر اجزا نجیب تر هستند اما چنین پوشش غیر طبیعی هرگز در سیستم آلیاژی فلزات گروه آهن با مس تشکیل نخواهد شد چراکه فلزات گروه آهن نسبت به مس کمتر نجیب هستند. فلزاتی که نسبت به فلزات گروه آهن کمتر نجیب هستند (پتانسیل الکترودهای استاندارد فلزات گروه آهن در مقابل NHE برای Ni، Co و Fe به ترتیب0.25-، 0.28- و 0.44- V [8]) و یونهای هیدراته آنها قادر هستند بر روی یک الکترود جامد در یک بازده جریان مشخص ترسیب شوند به تعداد کمی از فلزات محدود هستند که عبارتند از: (V0.4-) Cd، (V0.76-) Zn و (V1.18-) Mn [9]. در واقع این مسئله به این واقعیت منجر می شود که پوشش آلیاژی غیر طبیعی فقط در تعداد کمی از آلیاژ هایی که در بالا توضیح داده شد اتفاق می افتد.
2-2. خصوصیات متداول فلزات گروه آهن که ممکن است به ایجاد پوشش غیر طبیعی آلیاژی منجر شود:
علاوه بر نوع غیر طبیعی پوشش که پیشتر گفته شد، نوع دیگری از پوشش غیر معمول آلیاژی نیز وجود دارد که "نوع القا شده" نامیده می شود و در آن یک فلز بی میل مانند Mo یا W، که به تنهایی قابل ترسیب نیست، همراه با یک فلز از گروه فلزات آهن قابل ترسیب می شود [7]. بسیار جالب است که یک فلز گروه آهن لزوما یکی از اجزای تشکیل دهنده سیستم های آلیاژی غیر عادی است. این بدان معنی است که تشکیل آلیاژ غیر عادی باید به خصوصیات متمایز فلزات گروه آهن نسبت داده شود. از آنجایی که ترسیب فلزات از محلول های آبی به طور مستقیم با واکنش احیای هیدروژن بر روی کاتد در حال رقابت است، قابلیت ترسیب یک فلز خاص باید با میزان احیای نسبی هیدروژن و یونهای فلزی بر روی این فلز تعیین شود. این بدان معنی است که خواص فلز در هر دو حالت فلزی و یونی امکان ترسیب فلز را تعیین میکند، زیرا پتانسیل استاندارد الکترود یون فلزی/ فلز، بستگی به ثبات و به این ترتیب به خواص عنصر فلزی در هر دو حالت بستگی دارد، در حالی که اور پتانسیل هیدروژن به خواص حالت فلزی بستگی دارد.
خواص حالت یونی:
در میان فلزاتی که می توانند از محلول های آبی خودشان ترسیب شوند، تنها فلزات گروه آهن دارای اور پتانسیل هستند. فلزات گروه آهن در پتانسیلی که چند دهم کمتر از پتانسیل تعادلی واقعی آنها است شروع به ترسیب میکنند [10]، این درحالی است که اکثر فلزات دیگر در پتانسیل تعادلی خود ترسیب می شوند. این بدان معنی است که سایت های ترسیب شدن برای فلزات گروه آهن به طور قابل ملاحظه ای در کاتد محدود می شوند. بنابراین، می توان نتیجه گرفت هنگامی که سایتهای ترسیب بر روی کاتد توسط جذب مواد خارجی اشغال می شوند، باعث می شوند تا ترسیب فلزات گروه آهن به راحتی قطبی تر شوند. از سوی دیگر، از آنجایی که ترسیب فلزات گروه آهن ظاهرا (اما نه از منظر ترمودینامیکی) در پتانسیلهای کمتر از پتانسیل های تعادلی آنها اتفاق می افتد، ترسیب آنها میتواند در حضور کاتالیست های خاصی نسبت به پتانسیلهای تعادلیشان دپلاریزه شود. در مطالعۀ پلاروگرافی ترسیب نیکل به خوبی مشخص شده است که هنگامی که ترکیبات S- و N در الکترولیت وجود دارند به علت اتصالات آنیونی یا کمپلکس سطحی، pre-wave کاتالیزوری مشاهده می شود. [11] - [16]. بنابراین، پتانسیل ترسیب و به همین ترتیب پتانسیل تعادل ظاهری فلزات گروه آهن، به طور قابل ملاحظه ای با جذب مواد خارجی مانند مهار کننده یا کاتالیزور در این سایت ها تحت تاثیر قرار می گیرد.
به خوبی مشخص شده است که هیدروژن و همچنین فلزات گروه آهن ، دارای اور پتانسیل ترسیب هستند که به طور کلی به نام اور پتانسیل هیدروژن نامیده می شود. احیای هیدروژن بر روی الکترود جیوه که دارای اور پتانسيل بالای هیدروژن است، در حضور ترکیبات S- و N- بطور قابل ملاحظه ای دپلاریزه می شود [17]. این نکته نشان می دهد که هیدروژن دارای ویژگی هایی مشابه با فلزات گروه آهن است. از آنجا که در ترسیب یک فلز از محلول آبی (هنگام آبکاری) همیشه باید رفتار یون هیدروژن در نظر گرفته شود، این ویژیگی را نیز باید بطور مداوم در نظر داشت.
خواص در حالت فلزی:
از فلزاتی که می توانند از محلول های آبی خودشان ترسیب شوند، تنها فلزات گروه آهن، فرومغناطیس هستند. این به علت ساختار الکترونی فلزات گروه آهن است که تا اندازه ای با فلزات دیگر متفاوت است که آنها تعدادی الکترون جفت نشده (Fe 2.2، Co 1.6، Ni 0.6) دارند، و به علت توزیع غیر یکنواخت حفرات در دو زیر لایه d3 است [18]. وجود این الکترونهای جفت نشده، باعث شده تا فلزات گروه آهن در میان فلزاتی که می توانند از محلول های آبی با بازده جریان کاتدی بالا ترسیب شوند، بالاترین میزان گرمای جذب هیدروژن اتمی و همچنین تمایل زیاد برای جذب ترکیبات حاوی S- و N- که جفت الکترون تنها دارند، داشته باشند (جدول 2) [19]، [20]. بنابراين، فلزات گروه آهن داراي توانايي بالايي براي نگهداري موادي مانند هيدروژن اتمي و ترکیبات حاوی S- و -N در سطح خود هستند.
جدول 2 گرمای جذب هیدروژن اتمی بر روی فلزات مختلف (kJ / mol).
|
Ga*
|
Fe*
|
Al
|
Cu*
|
Cr
|
Cd*
|
Be
|
Au*
|
Ag*
|
|
236.5
|
253.2
|
244.8
|
251.5
|
225.6
|
243.6
|
248.2
|
242.7
|
240.6
|
|
Pd
|
Pb*
|
In*
|
Ni*
|
Nb
|
Mo
|
Mn
|
Mg
|
Hg*
|
|
249.0
|
232.7
|
251.9
|
283.3
|
275.4
|
240.6
|
228.9
|
236.5
|
221.4
|
| |
|
Zn*
|
W
|
V
|
Tl*
|
Ti
|
Ta
|
Pt
|
| |
|
229.8
|
287.1
|
258.2
|
231.4
|
255.3
|
287.1
|
263.2
|
⃰ فلزاتی که می توانند از محلول آبی با بازده جریان بالا ترسیب شوند
بر اساس خصوصیات متمایز فلزات گروه آهن که در بالا شرح داده شده است، نویسندگان حاضر پیشتر یک مکانیزم احتمالی برای ترسیب دوتایی القاشده Mo با فلزات گروه آهن پیشنهاد کرده اند و توضیح دادند که ترسیب آلیاژی نوع القا شده در شرایطی اتفاق می افتد که در آن جنبه های مطلوب خواص فلزات گروه آهن، از جمله دپلاریزاسیون ترسیب فلز گروه آهن و توانایی بالا برای نگه داشتن هیدروژن اتمی، مجاز به عملکرد خوب در ترکیب بودند، در حالی که ترسیب آلیاژی هرگز در شرایطی که خواص در حالت فلزی به دلیل خواص نامطلوب در حالت یونی، مانند پلاریزه شدن ترسیب فلزات گروه آهن قادر به عملکرد مطلوب نیست، اتفاق نخواهد افتاد [21] - [27].
از سوی دیگر، در ترسیب آلیاژی غیر طبیعی عموما پوشش مبتنی بر حضور درصد کمی از فلزات گروه آهن است، از سوی دیگر خواص فلزات گروه آهن در حالت فلزی ممکن است هیچ نقشی نداشته باشند، زیرا برای مثال اوربیتالهای d3 فلزات گروه آهن توسط الکترونهایs 4 زینک در آلیاژهای Zn با فلزات گروه آهن پر می شود.
2-3. مکانیسم مهار هیدروکسید
در حمام سولفاتی، فلزات گروه آهن و Zn موجود، در ساده ترین شکل یون آبپوشیده خود هستند. ترسیب Ni دریک حمامی که بعنوان مثال حاوی 0.9 مول بر لیتر یون فلزی است در حدود 0.43- ولت در مقابل NHE شروع می شود که عملا V 0.18 کمتر از پتانسیل تعادلی خود (0.25- ولت) می باشد[28]. به این ترتیب Ni، و همچنین سایر فلزات گروه آهن دارای اورپتانسیل ذاتی ترسیب هستند. با این حال، این اورپتانسیل ترسیب به اندازه کافی بزرگ نیست تا بتواند پتانسیل تعادلی ظاهری نیکل را که پتانسیل ترسیب نیکل است به پتانسیل تعادل Zn (غلظت روی 1 مول بر لیتر پتانسیل ترسیب آن معادل 0.76- ولت) نزدیک کند. بنابراین، نمیتوان ترسیب Zn بعنوان فلز عمده در پوشش آلیاژی را با توجه به اینکه بطور قابل توجهی از فلزات گروه آهن کمتر نجیب است صرفا با توجه با اور پتانسیل ذاتی فلزات گروه آهن توضیح داد چراکه عملا غیر ممکن است. همانطور که قبلا ذکر شد، ترسیب الکتریکی فلزات گروه آهن به راحتی تحت تاثیر جذب مواد خارجی مانند مهار کننده ها یا کاتالیزور در محل های ترسیب شدن آنها قرار می گیرد. بنابراين برای اینکه آلیاژی با درصد غالب Zn داشته باشیم، حضور بازدارنده در حمام جهت کنترل ترسیب فلزات گروه آهن ضروری می باشد. در ترسیب آلیاژی Zn با فلزات گروه آهن، به دلیل افزایش PH در مجاورت کاتد، هیدروکسید فلزی تشکیل شده ناشی از هیدرولیز به عنوان یک مهارکننده در نظر گرفته می شود [29]، [30].
2-3-1. انتقال رفتار ترسیب آلیاژی از نوع عادی به نوع غیر عادی و تشکیل هیدروکسید زینک [31]، [32].
به طور کلی، در ترسیب غیر عادی آلیاژ، تغییر ایجاد شده در ترکیب آلیاژ بوسیله تغییر متغیرهای آبکاری به ندرت یک تمایل (روند) مشخص را نشان می دهد [7]، و مشخصا این موضوع در زمانی که دانسیته جریان متغیر است، بیشتر دیده می شود. شکل 3 نتایج تجربی تاثیر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ را نشان می دهد. شرایط استاندارد آبکاری در جدول 3 آورده شده است. خط نقطه چین در شکل 3 خط مرجع ترکیب را نشان می دهد (در ادامه برای سادگی بصورت CRL اشاره می شود) و موقعیتی را نشان می دهد که در آن ترکیب درصد وزنی آلیاژ درست با ترکیب درصد فلز در حمام برابر است.
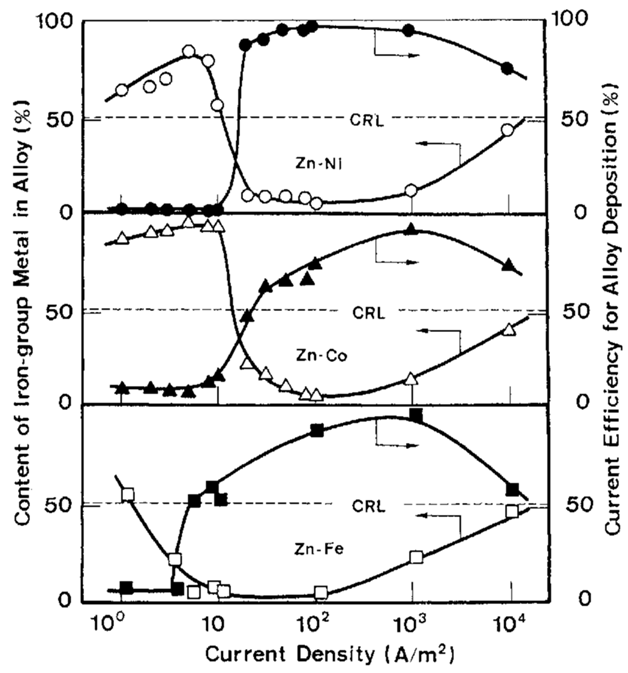
شکل 3: تاثیر دانسیته جریان بر روی ترکیب پوشش آبکاری شده، بر روی کاتد، بازده جریان برای ترسیب آلیاژ
جدول 3 شرایط استاندارد آبکاری برای آلیاژهای فلزات گروه آهن و Zn
|
Operating condition
|
Bath composition
|
|
Current density 10A/dm2
|
Zinc sulfate 0.5 mol/l
|
|
Electrolysis 100s
duration
|
Iron-group metal sulfate 0.5 mol/l
|
|
Quiescent bath
|
Sodium acetate 0.2 mol/l
|
| |
Sulfuric acid ⃰
|
⃰ مقدار مورد نیاز برای تنظیم pH در 3.0
در مواردی که میزان فلز گروه آهن در آلیاژ، بالای خط CRL باشد، ترسیب الکتریکی از نوع معمولی رخ می دهد، چون در مقایسه با حمام، نسبت فلز گروه آهن به Zn در آلیاژ بیشتر است و از این رو ترسیب الکتروشیمیایی فلز گروه آهن ارجح می باشد. از سوی دیگر، میزان فلز گروه آهن زیر خط CRL نشان دهنده ترسیب دوتایی غیرمعمول است که در آن گونه ارجح برای ترسیب Zn کمتر نجیب می باشد.
در دانسیته جریان های پایین، ترسیب دوتایی از نوع نرمال است در حالیکه بازده جریان کاتد بسیار ضعیف بود و نشان دهنده این است که احیای هیدروژن فرایند غالب است. با افزایش دانسیته جريان، مقدار فلز گروه آهن در آلیاژها به سرعت کاهش می یابد و متعاقبا بازده جریان به طور معنی داری افزایش می یابد. دانسیته جریانی که در آن ترسیب الکتروشیمیایی آلیاژ از یک حالت عادی به یک نوع غیر طبیعی تغییر می کند، دانسیته جریان گذار نامیده می شود [7]. افزایش بیشتر دانسیته جریان منجر به تغییر کمی در ترکیب آلیاژ می شود، به دنبال این روند محتوای فلزی گروه آهن به تدریج افزایش پیدا کرده تا جایی که در دانسیته جریانهای بالاتر به خط CRL می رسد. رفتار ترسیب آلیاژ در دانسیته جریان های بالاتر از دانسیته جريان گذار بعدا در ارتباط با ترسیب دوتایی غیر طبیعی Ni با Zn شرح داده خواهد شد.
سپس آلیاژها تحت شرایط مشابه با مطالعه نشان داده شده در شکل 3 ترسیب داده شدند و pH در لایه کاتدی(در موقعیت دقیقا 10 میکرومتری از کاتد) بصورت همزمان با استفاده از روش میکروالکترودهای Sb اندازه گیری شد [33]. نتایج حاصل در شکل 4 خلاصه شده است که در آن رابطه بین ترکیب آلیاژ و pH در مجاورت کاتد آورده شده است. این شکل همچنین شامل CRL، pH محلول بالک و مقادیر بحرانی pH برای هر هیدروکسید فلزی است که با اندازه گیری انحلال پذیری آنها در PH های مختلف در حمام مورد استفاده تعیین شده اند.
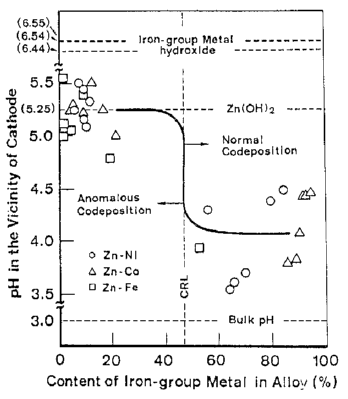
شکل 4: رابطه بین ترکیب آلیاژها و pH در مجاورت کاتد در طول موقعیت الکترود آلیاژهای فلزی آهن-Zn.
شکل 4 نشان داد که pH بحرانی برای رسوب هیدروکسید Zn در منطقه ترسیب دوتایی نرمال بدست نمی آید، اگر چه افزایش pH در لایه کاتد در مقایسه با محلول بالک تا حدودی مشاهده شد. از سوی دیگر، زمانیکه انتقال ترسیب دوتایی از حالت نرمال به نوع غیر طبیعی رخ می دهد، افزایش ناگهانی PH منجر به ترسیب هیدروکسید زینک می شود. در منطقه ترسیب دوتایی غیر طبیعی، pH لایه کاتد در مقادیری نزیک به pH بحرانی برای رسوب هیدروکسید Zn باقی می ماند که بسیار پایین تر از pH بحرانی برای هیدروکسید های فلزات گروه آهن می باشد.
2-3-2. مکانیسم انتقال ناگهانی از یک رسوب نوع معمولی به حالت غیر طبیعی در دانسیته جریان گذار.
در حمام سولفاتی مورد استفاده، یون هایی که قادرهستند در کاتد احیا شوند، هیدروژن، فلزات گروه آهن و Zn هستند و در ساده ترین شکل یون های هیدراته خود حضور دارند. از این یونها، همانطور که قبلا ذکر شد، Zn، مانند بسیاری از فلزات دیگر، در پتانسیل تعادلی خود شروع به ترسیب می کند، در حالی که فلزات گروه آهن و هیدروژن دارای خصوصیات ذاتی هستند که نمی توانند در پتانسیل تعادل خود ترسیب شوند، بلکه به یک اورپتانسیل نیاز دارند.
همانطور که در 2-3-1 توضیح داد شد، رسوب آلیاژی نوع معمولی با بازده جریان بسیار ضعیف در دانسیته جریانهای پایین تر از دانسیته جریان گذار اتفاق می افتد، در حالیکه ترسیب آلیاژ غیر طبیعی با بازده جریان نسبتا بالا پس از رسیدن دانسیته جریان گذار به دست می آید.
در منطقه دانسیته جريان پايين، هر يون قابل ترسیبی در فرم يوني در لايه كاتدی وجود دارد زيرا pH بحراني براي رسوب هيدروكسيد Zn و همچنين هيدروكسيد فلزات گروه آهن به دست نمي آيد (شكل 4). از آنجایی که پلاریزاسیون پتانسیل تعادل ظاهری هیدروژن و فلزات گروه آهن حتی با وجود پلاریزاسیون ذاتی که دارند به حدی نیست که بیش از پتانسیل تعادلی Zn باشد، لذا ترسیب ناچیز هیدروژن و فلزات گروه آهن باید مستقیما مربوط به رفتارهای ترسیب آنها در طی رسوب همزمان باشد. بنابراین، درحالت عادی احیای هیدروژن به عنوان نجیب ترین گونه ترجیح داده می شود و پس از آن به میزان کمی فلزات گروه آهن می باشند، که دلیل اصلی پایین بودن بازده جریان برای رسوب آلیاژی از نوع نرمال است.
با افزایش دانسیته جریان، pH در لایه کاتد به علت افزایش سرعت احیای هیدروژن که منجر به تشکیل هیدروکسید Zn و جذب آن در کاتد می شود در حالیکه در این pH فلزات گروه آهن در لایه کاتدی به دلیل بافری شدن محلول بواسطه هیدرولیز Zn در pH زیر pH بحرانی برای رسوب این هیدروکسید های فلزی به صورت یونی باقی می مانند. سپس، پتانسیلهای تعادل ظاهری هیدروژن و فلزات گروه آهن که پتانسیلهای ترسیب آنها به طور ذاتی تحت تاثیر جذب مواد خارجی قرار می گیرد، بیشتر قطبی می شوند و نیرو محرکه برای رسوب آنها به طور قابل توجهی کاهش می یابد. هنگامی که الکترولیز تحت شرایط گالوانوستاتیک انجام می شود، این شرایط منجر به پلاریزاسیون ناگهانی کاتد در دانسیته جریان گذار به سمت پتانسیل رسوب یون بعدی که همان Zn است می شود. از آن جایی که از نظر ترمودینامیکی پتانسیلهای تعادلی برای رسوب Zn از یون هیدراته شده و هیدروکسید آن در pH بحرانی برای رسوب هیدروکسید Zn یکسان است، لذا تغییر پتانسیل تعادلی به دلیل تشکیل هیدروکسید Zn لازم نیست. بنابراین، زمانی که کاتد برای رسیدن به پتانسیل ترسیب آن پلاریزه می شود ترسیب زینک شروع می شود و با شکل گیری هیدروکسید یون ماقبل به راحتی پیش می رود. از آن جایی که پتانسیل تعادل ظاهری فلز گروه آهن لازم است پلاریزه شود تا به بیش از پتانسیل تعادل Zn برسد و احیای هیدروژن توسط اورپتانسیل بزرگ هیدروژن بر روی Zn همراه با پلاریزاسیون بدلیل هیدروکسید Zn جذب شده کاهش بیشتری می یابد، لذا رسوب آلیاژ غیر معمول با بازده جریان بالا حاصل می شود.
در حال حاضر، توضیح پیشنهاد شده بالا توسط نویسندگان به عنوان محتملترین توضیح درنظر گرفته می شود و به عنوان مکانیزم مهار هیدروکسید نامیده می شود [30].
2-3-3. تأثیر ظرفیت بافر یک حمام آبکاری آلیاژیZn-Ni بر روی دانسیته جریان گذار - تایید مکانیسم مهار هیدروکسید [34].
با توجه به مکانیسم مهار هیدروکسید، دانسیته جریان گذار تقریبا با حداقل مقدار دانسیته جریان مورد نیاز برای احیای هیدروژن که pH لایه کاتد را به مقدار بحرانی برای رسوب هیدروکسید Zn می رساند برابر است، چراکه احیای هیدروژن در دانسیته جریان پایین، جایی که رسوب آلیاژی نوع عادی در آن رخ می دهد غالب است. بنابراین، هر تغییری در شرایط آبکاری که از افزایش pH در لایه کاتد جلوگیری کند، انتقال از حالت رسوب نرمال به رسوب آلیاژ نوع غیر طبیعی را با افزایش دانسیته جریان گذار مشکل می کند.
بنابراین، آلیاژها در دانسیته جریانهای مختلف از چندین حمام که در جدول 4 لیست شده اند ترسیب شدند و دانسیته جریان گذار در هر حمام تعیین شد. دانسیته های جریان گذار در شکل 5 به عنوان تابعی از ظرفیت بافر رسم شدند که بصورت مقدار تئوری هیدروکسید سدیم مورد نیاز برای رسیدن به رسوب هیدروکسید Zn در هر حمام بیان شده است. همانطور که در شکل 5 نشان داده شده است، دانسیته جریان گذار متناسب با افزایش ظرفیت بافر در حمام افزایش می یابد و نشان دهنده درست بودن مکانیسم مهار هیدروکسید است.
گزارش شده است هنگامی که شرايط مناسب احیای بالای فلز در لايه انتشار کاتد است، به عنوان مثال در دماي پايين يا در حمام هایی که غلظت یون فلزی کل در آنها کم است، دانسیته جريان گذار پايين تر است [7]،[30]. همانطور که در شکل 5 نشان داده شده است، با این حال، گذارها تقریبا در همان دانسیته جریان 0.1 A/dm2 برای حمام 10، 15 و 16 که در آنها غلظت کل یون فلز به شدت از یکدیگر متفاوت بود، مشاهده شد.
جدول 4 ترکیب و ظرفیت بافری حمام
|
16
|
15
|
14
|
13
|
12
|
11
|
10
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
|
|
0.05
|
0.1
|
0.9
|
0.7
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
ZnSO4.7H2O
|
|
0.05
|
0.1
|
0.1
|
0.3
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
0.5
|
NiSO4.6H2O
|
|
0.9
|
0.8
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
0.5
|
0.5
|
-
|
-
|
-
|
-
|
-
|
Na2SO4
|
|
0.2
|
0.2
|
0.2
|
0.2
|
1.0
|
0.5
|
0.2
|
0.05
|
0.5
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
CH3COONa.3H2O
|
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
⃰
|
H2SO4
|
|
3.0
|
3.0
|
3.0
|
3.0
|
3.0
|
3.0
|
3.0
|
3.0
|
2.0
|
2.0
|
1.0
|
3.0
|
2.5
|
2.0
|
1.5
|
1.0
|
pH
|
|
47.3
|
47.3
|
89.0
|
67.7
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
47.3
|
Metal- %Ni bath
|
|
0.1
|
0.2
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
1.0
|
Total metal Ion Conc.
|
|
0.294
|
0.292
|
0.292
|
0.287
|
1.04
|
0.568
|
0.284
|
0.141
|
1.29
|
0.998
|
2.67
|
0.094
|
0.271
|
0.670
|
1.27
|
1.84
|
Bufer capacity
|
کلیه غلظت ها بر اساس مول هستند، ⃰ مقدار لازم برای تنظیم pH
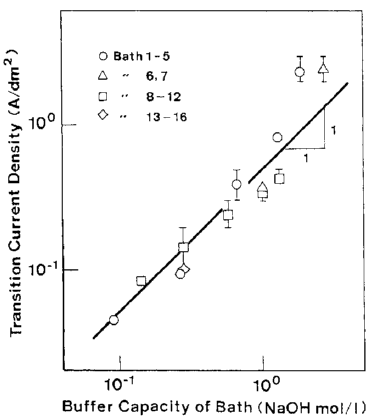
شکل 5: ارتباط بین دانسیته جریان انتقال و ظرفیت بافری حمام
از آنجایی که یون های فلزی معمولا به صورت سولفات فلزی به حمام سولفاتی اضافه می شوند، غلظت یون سولفات که غالبا به عنوان یک عامل بافر کننده عمل می کند در حمام های با غلظت کل یون فلزی پایین کمتر است، مگر اینکه از منبع دیگری به حمام سولفات اضافه شود. بنابراین کاهش غلظت کل یون فلز باعث کاهش ظرفیت بافر در حمام می شود. علاوه بر این، کاهش درجه حرارت باعث کاهش نرخ انتشار یون هیدروژن به کاتد می شود. در نتیجه، نتیجه گیری می شود که دانسیته جریان گذار با تغییرات شرایط آبکاری کاهش می یابد که منجر به احیای یون هیدروژن در لایه کاتد می شود.
2-4. رفتار ترسیب آلیاژهای Zn-Niاز حمام های سولفاتی و توضیح آن بر اساس مکانیسم مهار هیدروکسید [34].
آلیاژها بر روی یک کاتد مسی 2 سانتی متر در 2 سانتیمتر تحت شرایط کولستاتیک (10 C/cm ) و شرایط گالوانوستاتیکی در دمای 313 درجه کلوین (40 درجه سانتیگراد) از حمامهای ساکن (شماره 10، 13-16 در جدول 4) ترسیب داده شدند که در آنها میزان فلز نیکل یا غلظت کل یون فلز متغیر بود، در حالی که ظرفیت بافر تقریبا ثابت نگاه داشته شد بود.
شکل 6 اثر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای رسوب آلیاژ از حمام 10 را نشان می دهد که در کار قبلی ما به عنوان یک حمام استاندارد مورد استفاده قرار گرفت [32]. شکل 6 همچنین بطور همزمان شامل منحنی اندازه گیری شده پلاریزاسیون در طول زمان رسوب آلیاژ است. شکل 7 و 8 رابطه مشابهی را نشان می دهند که در شکل 6 در حمام هایی با فلزات مختلف نیکل (حمام 13، 14) و در حمام ها دارای غلظت متفاوت یون فلزی کل است (حمام 15، 16).
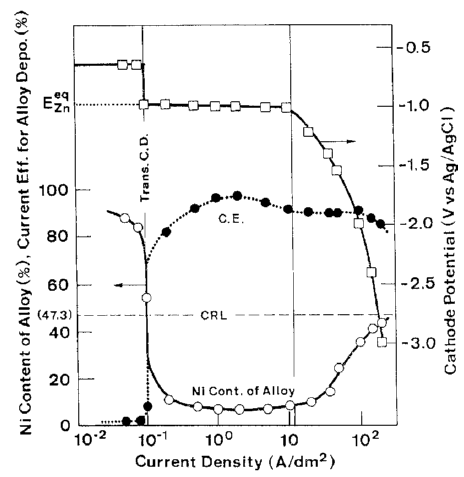
شکل 6: اثر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان و منحنی پلاریزاسیون درطول ترسیب آلیاژ از حمام 10
تغییرات در ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ همان روند را نشان می دهد که در شکل 3 دیده شد، اگرچه رفتار ترسیب آلیاژ در دانسیته جریانهای بالاتر با جزئیات بیشتر تبیین شده است.
با توجه به شکلهای 6، 7 و 8، به طور کلی رفتار ترسیب آلیاژ با توجه به دانسیته جریان همانطور که بصورت شماتیک در شکل 9 نشان داده شده است می تواند به چهار بخش زیر تقسیم شود: منطقه I که در آن دانسیته جريان کم است و در این منطقه ترسیب آلیاژ از نوع عادی با بازده جریان پایین اتفاق می افتد؛ منطقه II که در آن ترسیب آلیاژ با ترکیب درصد فلز کمتر نجیب Zn با بازده جریان بالاتر بطور قابل ملاحظه ای در اولویت است و در این منطقه ترکیب آلیاژ به سختی تغییر می کند؛ منطقه III که در آن مقدار نیکل آلیاژها با افزایش دانسیته جریان افزایش می یابد در حالیکه بازده جریان نسبتا بالا برای رسوب آلیاژ همچنان حفظ می شود؛ و منطقه IV که در آن محتوای نیکل بیشتر به سمت CRL افزایش می یابد در حالی که بازده جریان برای رسوب آلیاژ به طور ناگهانی کاهش می یابد.
رفتار ترسیب آلیاژ در منطقه I و انتقال آن به منطقه II پیش از این در 2-3-2 توضیح داده شده است. رابطه بین دانسیته جريان کل و دانسیته جريانهای جزئي برای رسوب هر فلز و احیای هيدروژن در شکل 10 نشان داده شده است که نتايج آن به عنوان مثال براي حمام هاي 10 و 15 ارائه شده است. با استفاده از این شکل، توضیح رفتار ترسیب آلیاژ در مناطق II، III و IV در زیر آمده است.
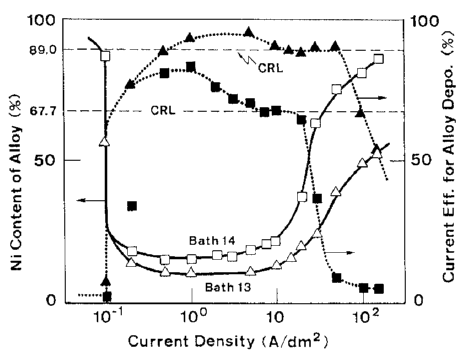
شکل 7: تاثیر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ از حمام های حاوی % مقادیر مختلفی از فلز نیکل
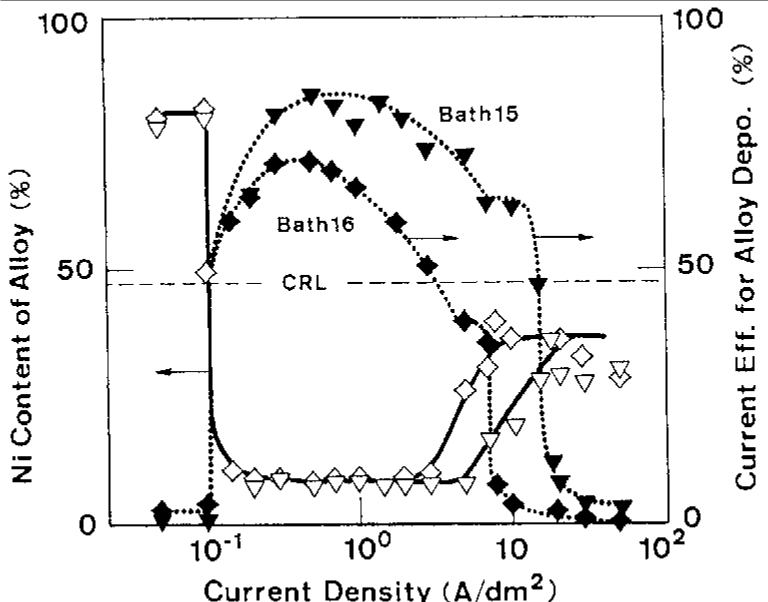
شکل 8: اثر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای ترسیب آلیاژ از حمام حاوی مقادیر مختلفی از غلظت کل یون فلزی (حمام 15 و 16)
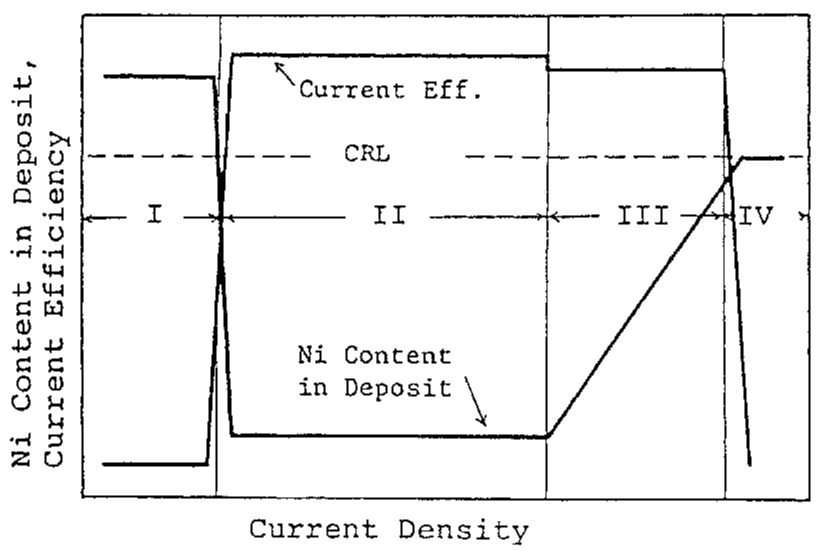
شکل 9 نمایش شماتیک رفتار پوشش آلیاژ
در ناحیه ترسیب دوتایی غیر طبیعی II، رسوب Zn از هیدروکسید آن حاصل می شود و نجیبتر از نیکل یا هیدروژن رفتار می کند. احیای نیکل و هیدروژن، همانطور که قبلا توضیح داده شد، به شدت تحت تأثیر حضور هیدروکسید Zn قرار دارد که وجود آن بستگی به میزان نسبی تشکیل شیمیایی و مصرف الکتروشیمیایی آن دارد. میزان تشکیل شیمیایی هیدروکسید Zn با فعالیت های هر دو یون OH و Zn بر روی کاتد تعیین می شود.
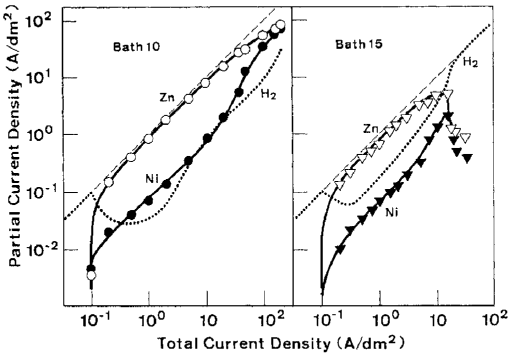
شکل 10: ارتباط بین دانسیته جریان کل و داسیته های جریان جزئی برای ترسیب هر فلز و احیای هیدروژن در حمام های 10 و 15
با توجه به اینکه ثابت نرخ تبدیل هیدروکسید به اندازه کافی بزرگ است، تا زمانی که یون های Zn کافی از محلول بالک تامین شوند و هیچ رسوبی از Zn تحت کنترل انتشار آغاز نشود میزان تشکیل هیدروکسید Zn توسط یونهای OH تولید شده توسط احیای هیدروکسید Zn و همچنین هیدروژن در کاتد تعیین می شود. از سوی دیگر، سرعت مصرف الکتروشیمیایی هیدروکسید Zn دقیقا برابر با جریان ترسیب Zn است. همانطور که سرعت تشکیل یون OH پس از گذار افزایش می یابد، سرعت تشکیل هیدروکسید Zn همیشه بالاتر از مصرف است و منجر به وجود هیدروکسید کاهش نیافته مازاد می شود. در حضور یک مقدار کافی از هیدروکسید Zn جذب شده، و پس از آن، ترسیب آلیاژ نوع غیر طبیعی به راحتی در پتانسیلی که کمی از پتانسیل تعادل Zn نشان داده شده در شکل 6 کمتر نجیب است رخ می دهد. در این منطقه، همانطور که در شکل 10 نشان داده شده است، دانسیته جریان جزئی Zn برای اغلب دانسیته جریان کل محاسبه می شود. دانسیته جریان جزیی نیکل حدود یک دهم دانسیته جریان کل است که نشان دهنده بازده جریان تقریبا ثابت 10٪ است. به عنوان مثال، تغییر بازده جریان جزئی Zn از 85 به 70 درصد، منجر به تغییر کمی در مقدار نیکل آلیاژ از 9.7 به 11.4 درصد می شود. بنابراین ترکیب آلیاژی در این منطقه به ندرت در حال تغییر است.
همانطور که در شکل 10 نشان داده شده است، با افزایش بیشتر دانسیته جریان، بدلیل اینکه Zn در ناحیه ترسیب دوتایی غیر طبیعی به عنوان فلز نجیبتر رفتار می کند، ترسیب Zn تا رسیدن به جریان حد خود بعنوان رسوب ارجح نسبت به Ni شروع می شود. هنگامی که ترسیب Zn شروع به رسیدن به جریان حد خود در منطقه III می کند، سرعت تشکیل شیمیایی هیدروکسید Zn به دلیل کاهش غلظت یون های Zn در کاتد کاهش می یابد، در حالی که سرعت مصرف الکتروشیمیایی به تدریج به سمت جریان حد Zn افزایش می یابد. بنابراین با افزایش دانسیته جریان، مقدار هیدروکسید Zn جذب شده به تدریج کاهش می یابد و منجر به دپلاریزاسیون تدریجی پتانسیل تعادلی ظاهری نیکل و هیدروژن می شود. علاوه بر این، همانطور که در شکل 6 نشان داده شده است، کاتد به علت پلاریزاسون غلظت رسوب Zn بیشتر قطبیده می شود. این مسئله منجر به افزایش نیروی محرکه برای رسوب هیدروژن و همچنین نیکل می شود. در این منطقه، همانطور که در شکل 10 نشان داده شده است، رسوب نیکل نسبت به احیای هیدروژن در اولویت است، که منجر به افزایش میزان نیکل آلیاژها نسبت به CRL و بازده جریان نسبتا بالا و ثابت برای رسوب آلیاژ می شود. با توجه به این بحث، منطقه III، و از این رو، بخش رو به رشد منحنی محتوای Ni در شکل 9، باید با کاهش مقدار غلظت یون Zn در حمام به سمت چپ جابجا شود. چراکه جریان حد برای رسوب Zn در دانسیته جریان پایین تر در حمامهای با غلظت یون Zn کمتر به دست می آید. این موضوع در شکل 6، 7 و 8 نشان داده شده است.
در منطقه IV جایی که جریان حد برای رسوب Zn تقریبا به دست می آید (شکل 10)، هیدروکسید Zn جذب شده تا حد زیادی کاهش می یابد که اجازه می دهد تا دپلاریزاسیون پتانسیل تعادلی ظاهری هیدروژن به سطح اولیه آن برسد. بنابراین، احیای هیدروژن بعنوان پدیده غالب باعث کاهش قابل ملاحظه ای در بازده جریان ترسیب آلیاژ می شود. علاوه بر این، همچنان که ثابت شد با کاهش ناگهانی جریان های ترسیب هر دو فلز در دانسیته جریانهای بالا ( حمام 15 در شکل 10)، رسوبات پودری شده و از سطح کاتد فرو میریزند. این مسئله همچنین به کاهش بازده جریان برای ترسیب آلیاژ کمک کرده است.
2-5. چندین نتایج تجربی نشان دهنده نقش فلزات گروه آهن در ترسیب آلیاژ نوع غیر طبیعی است.
2-5-1 رسوب آلیاژZn-Cd از حمام سولفاتی [35].
اگر فرض شود که خصوصیات فلز گروه آهن که در 2-2 توضیح داده شد، دلیل اصلی ظهور رسوب غیر طبیعی آلیاژ Zn با فلزات گروه آهن نمی باشد، اما احتمال افزایش ترسیب دوتایی غیر طبیعی وجود دارد همچنین ممکن است در رسوبات همزمان Zn با سایر فلزاتی که نجیب تر از Zn هستند و در یک pH بالاتر هیدرولیز می شوند اتفاق بیفتد. به عنوان یک مثال برای چنین فلزی، ما می توانیم Cd را پیدا کنیم که پتانسیل الکترود استاندارد و pH بحرانی آن برای تشکیل هیدروکسید با Fe قابل مقایسه است. در طول ترسیب آلیاژ Zn-Cd، Cd باید از یون هیدراته شده خودش در حضور هیدروکسید Zn جذب شده در کاتد رسوب کند.
جدول 5 شرایط استاندارد آبکاری برای آلیاژهای Zn-Cd.
|
Operating condition
|
Bath composition
|
|
500 A/m2
|
Current density
|
0.92 mol/1 (60 g/l as Zn)
|
Zn sulfate
|
|
40 oC
|
Temperature
|
0.018 mol/l (2 g/l as Cd)
|
Cd sulfate
|
|
300 kC/m
|
Amount of charge
|
0.1 g/1
|
Glue
|
|
Quiescent bath
|
⃰
|
Sulfuric acid
|
ضروری است که pH محلول در 3 تنظیم شود
آلیاژها تحت شرایط نشان داده شده در جدول 5 از حمام سولفاتی بدست آمدند. تاثیرات ترکیب حمام و دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان برای رسوب آلیاژ در شکلهای 11 و 12 نشان داده شده است. از این شکلها می توان دریافت که در شرایط مورد مطالعه، ترسیب آلیاژ از نوع عادی بوده است. منحنی قطبش جزئی برای رسوب هر فلز با استفاده از حمامهای حاوی Zn و یا Cd اندازه گیری شد. هر یک از حمامهای حاوی تک فلزی با حذف فلز دیگر از حمام آبکاری آلیاژ تهیه شد. نتایج در شکل 13 نشان داده شده است. شکل 14 همچنین تغییرات در ترکیب آلیاژ و بازده جریان بدست آمده از شکل 12 را نشان می دهد. همان طور که در شکل 13 نشان داده شده است، منحنی قطبش جزئی برای رسوب هر فلز از یک حمام آبکاری آلیاژی در تطابق خوبی با آنچیزی است که از حمام تک فلزی متناظر آن حاصل می شود. Cd بعنوان فلز نجیبتر در پتانسیل تعادل خود شروع به ترسیب کرد و سرعت ترسیب Cd به سرعت به جریان حد خود می رسد. هنگامی که کاتد نسبت به پتانسیل تعادلی Zn تحت انتشار کنترل شده Cd پلاریزه شد، ترسیب Zn آغاز شد. بنابراین رسوب این آلیاژ با در اولویت بودن ترسیب Cd بعنوان فلز نجیب تر در پتانسیل های نجیب رفتار نوع معمولی را بروز می دهد و همچنین کاهش سریع محتوای Cd آلیاژها به سمت CRL در پتانسیل های کمتر نجیب را نشان می دهد جایی که Zn نیز در آنها ترسیب می شود و با کاهش پتانسیل، سرعت رسوب Zn افزایش می یابد.
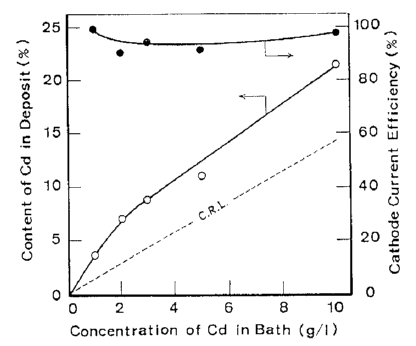
شکل 11 تاثیر غلظت Cd در حمام بر روی ترکیب آلیاژ و بازده جریان کاتد برای ترسیب آلیاژ
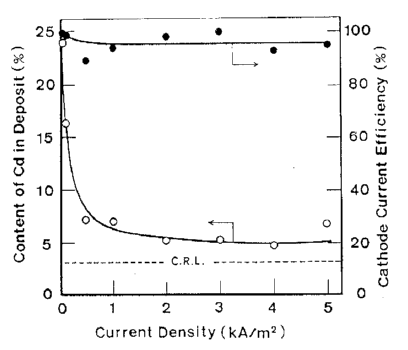
شکل 12 تاثیر دانسیته جریان بر روی ترکیب آلیاژ و بازده جریان کاتدی برای ترسیب آلیاژ
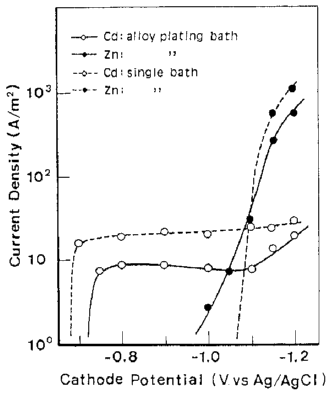
شکل 13 منحنی پلاریزاسیون جزئی برای ترسیب Zn و Cd از حمام آبکاری آلیاژی و حمام تک فلزی آنها
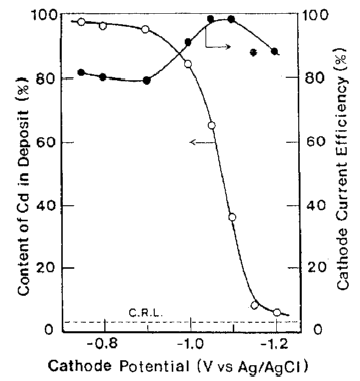
شکل 14 تاثیر پتانسیل کاتد بر روی ترکیب آلیاژ و بر روی بازده جریان کاتدی برای ترسیب آلیاژ
همانطور که در بالا گفته شد، هیچ رسوب آلیاژی غیر طبیعی در سیستم Zn-Cd مشاهده نشد. این نشان می دهد که خصوصیات متمایز فلزات گروه آهن که در 2-2 شرح داده شده است، برای ظهور رسوب الکتریکی غیرطبیعی فلزات گروه آهن با Zn ضروری است.
2-5-2. رسوب آلیاژ Cd-Niاز یک حمام سولفات [36].
رسوب آلیاژ Cd-Ni یکی از بهترین نمونه های شناخته شده ترسیب دوتایی غیر طبیعی است که در آن از نظر الکتروشیمیایی ترسیب Cd بعنوان فلز کمتر نجیب در اولویت است. با این حال، در این مورد، بدلیل اینکه pH بحرانی برای هیدروکسید فلزی در نیکل کمتر از Cd است نمیتوان انتظار تشکیل هیدروکسید فلز کمتر نجیب را داشت.
منحنی های پتانسیل کاتدی-دانسیته جریان جزئی برای ترسیب هر فلزی از حمام های حاوی Ni و / یا Cd در شکل های 15، 16 و 17 نشان داده شده است. حمام آبکاری آلیاژی حاوی 0.9 مول بر لیتر نیکل سولفات، 0.1 مول بر لیتر کادمیوم سولفات، 0.2 مول بر لیتر سدیم استات و مقداری سولفوریک اسید لازم برای تنظیم pH محلول تا 3 است. حمام تک فلزی با حذف Ni یا Cd از حمام آبکاری آلیاژی تهیه شد. اندازه گیری در یک حمام غیر متلاطم با دمای 30 درجه سانتیگراد انجام شد.
رسوب Cd از حمام تک فلزی مربوطه در پتانسیل تعادل خود (-0.65 V در مقابل Ag/AgCl ) آغاز شد و سرعت رسوب آن تقریبا بلافاصله به جریان حد خود افزایش یافت. این روند تقریبا مشابه ترسیب Cd از حمام آبکاری آلیاژی بود. از سوی دیگر، Ni از حمام تک فلزی مربوطه خود در پتانسیلی که به میزان قابل توجهی از پتانسیل تعادلی خودش کمتر نجیب بود شروع به ترسیب شدن کرد (-0.23 V در مقابل Ag/AgCl ) و سرعت رسوب آن به تدریج به جریان حد افزایش یافت. این روند تقریبا همانند روند حمام آبکاری آلیاژی است. این نشان می دهد که پتانسیل ترسیب قطبیده شده Ni در حمام آبکاری آلیاژی، که تقریبا قابل مقایسه با پتانسیل ترسیب Cd است، ناشی از برهم کنش با Cd نیست.
بنابراين مي توان نتيجه گيري کرد که اولویت داشتن ترسیب Cd فقط ناشی از اور پتانسیل ذاتی ترسیب Ni است که در 2-2 توضیح داده شد. شکل 18، وابستگی بالقوه ترکیب واقعی آلیاژ را همراه با مقدار محاسبه شده در شکل های 15 و 16 نشان می دهد. روند هر دو منحنی به خوبی در انطباق باهم هستند، که نشان دهنده اعتبار بحث فوق است.
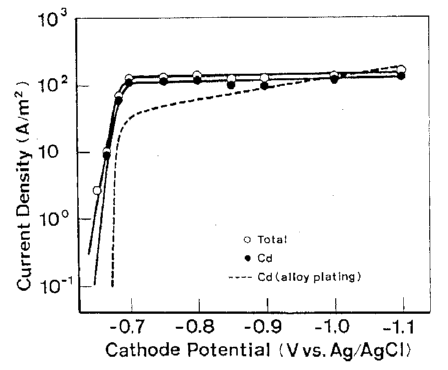
شکل 15 منحنی پلاریزاسیون در ترسیب منفرد Cd
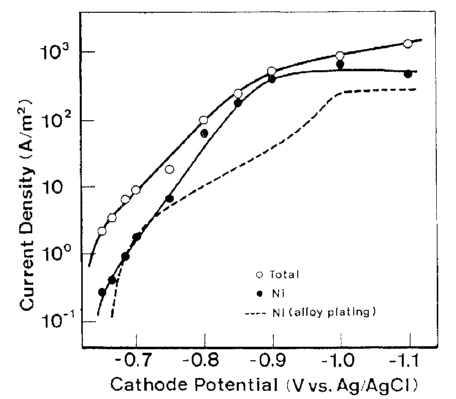
شکل 16 منحنی های پلاریزاسیون در ترسیب Ni منفرد
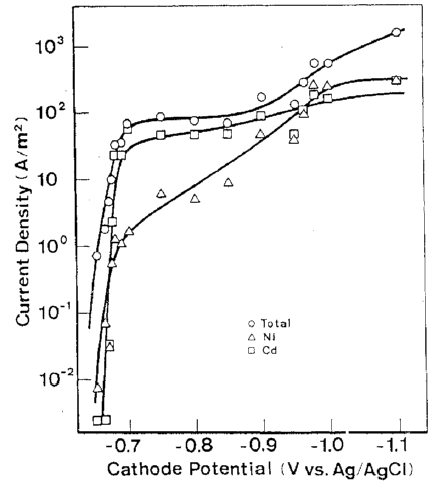
منحنی های پلاریزاسیون در ترسیب آلیاژ Ni-Cd
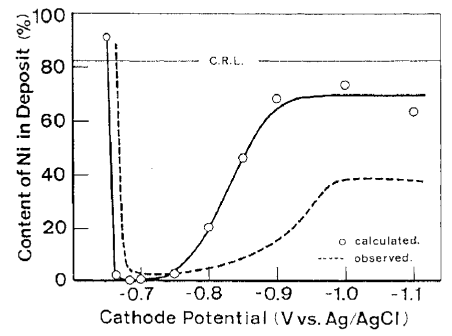
شکل 18 ترکیب محاسبه شده آلیاژ ، با فرض اینکه سرعت ترسیب آلیاژ بصورت جمع سرعتهای ترسیب منفرد هریک از اجزای Ni و Cd بیان می شود
2-5-3. عوامل تعیین مکانیزم رسوب آلیاژ غیر طبیعی.
همانطور که تاکنون توضیح داده شد، خواص فلزات گروه آهن در حالت یونی نقش مهمی در رسوب آلیاژ غیر طبیعی ایفا می کند. در ترسیب آلیاژ Cd-Ni، همانطور که در 2-5-2 نشان داده شده است، اور پتانسیل ذاتی بزرگ ترسیب Ni، مسئول اصلی رسوب آلیاژ دوتایی غیر طبیعی است. از سوی دیگر در ترسیب Zn با فلزات گروه آهن، مهار کنندهای مانند هیدروکسید Zn که موجب قطبش اضافی فلزات گروه آهن شد، لازم بود. با تلفیق فاکتور الکتروشیمیایی پتانسیل الکترود تنهای هر فلز با فاکتور شیمیایی pH بحرانی برای هر هیدروکسید فلزی، می توان برآورد کرد که کدام یک از دو نوع ترسیب دوتایی غیر طبیعی فوق در هر یک سیستمهای آلیاژی اتفاق خواهد افتاد.
جدول 6 پتانسیل الکترودهای استاندارد [8] فلزات گروه آهن و دیگر فلزات را که از فلز گروه آهن کمتر نجیب (فعالتر) هستند و از اینرو می توانند از یون های هیدراته شده با بازده جریان بالا ترسیب داد شوند را نشان می دهد[9]. جدول 6 همچنین pH بحرانی را برای ترسیب هر هیدروکسید فلزی از محلول حاوی 1 مول بر لیتر هر یون فلزی نشان می دهد [8]. در ترسیب الکتریکی آلیاژهای Cd-Ni و Cd-Co، قطبش فلز گروه آهن به علت هیدروکسید Cd جذب شده قابل انتظار نیست چون وقتی PH در لایه کاتد افزایش می یابد تشکیل هیدروکسید فلز گروه آهن نسبت به هیدروکسید Cd در اولویت است. با این حال، در این مورد، تفاوت در پتانسیلهای الکترود تنها در هر دو جزء نسبتا کوچک است (0.13 و 0.15V)، و برتری فلزات گروه آهن نسبت به Cd در نجیب تر بودن تنها می تواند از طریق اورپتانسیل ذاتی فلزات گروه آهن لغو شود. از سوی دیگر، در ترسیب الکتریکی آلیاژهای فلزات گروه آهن با Zn، تفاوت در پتانسیل الکترودهای تنها بین هر دو جزء 0.32 تا 0.51 V است که به نظر می رسد بیش از حد بزرگ باشد که بخواهد صرفا بدلیل اورپتانسیل ذاتی ترسیب فلزات گروه آهن منتفی شود. با این حال، در این مورد، هیدروکسید Zn در pH پایین تری از هیدروکسید های فلزات گروه آهن تشکیل می شود. بنابراین، رسوب فلز گروه آهن توسط هیدروکسید Zn جذب شده بیشتر قطبیده می شود، که منجر به از بین بردن برتري فلزات گروه آهن در نجیب تر (غیر فعالتر) بودن الکتروشیمیایی می شود.
جدول 6 عوامل الکتروشیمیایی و شیمیایی تأثیرگذار بر وقوع رسوب دوتایی غیرطبیعی در سیستم ترکیبی فلزات گروه آهن نجیب تر با سایر فلزات کمتر نجیب
|
Mn
|
Zn
|
Cd
|
Fe
|
Co
|
Ni
|
element
|
|
-1.179
|
-0.763
|
-0.403
|
-0.440
|
-0.277
|
-0.25
|
E°(V vs NHE)
|
|
7.655
|
5.48
|
6.905
|
6.645
|
6.30
|
6.09
|
pHcri(calculated at 1 mol/1)
|
| |
5.25
|
7.41
|
6.44
|
6.54
|
6.55
|
pHcri(determined in the bath used)
|
علاوه بر این، اجازه دهید الکترولیز محلول حاوی فلزات گروه آهن و منگنز را در نظر بگیریم. در این مورد، تفاوت در پتانسیل الکترودهای تنها بین هر دو جزء بسیار زیاد است (0.74 - 0.93 ولت) و هیچ هیدروکسید منگنزی تشکیل نمی شود. بنابراین، رسوب آلیاژ به ندرت از محلول حاوی این یونهای هیدراته شده رخ می دهد. یک عامل کمپلکس دهنده مانند پیرو فسفریک اسید برای ترسیب این آلیاژ مورد نیاز است [37].
2-5-4. ترسیبZn باNi در پتانسیلی کمتر از پتانسیل تعادل هر یک از اجزا
همان طور که در شکل 6 نشان داده شده است، مقادیر قابل توجهی از آلیاژهای Zn-Ni در منطقه I که دانسیته پایینی دارد ترسیب می شوند که در آن پتانسیل کاتد از نظر ترمودینامیکی قطبییده نشده است تا منجر به ترسیب Zn شود. این به این معنی است که رسوب Zn در پتانسیل هایی که نجیبتر از مقدار پتانسیل تعادلی آن هستند اتفاق می افتد. مکانیسمی که اجازه می دهد ترسیب Zn در پتانسیلهای پایین ممکن شود. همانطور که قبلا ذکر شد، در ترسیب غیر طبیعی آلیاژی Zn با فلزات گروه آهن خواص فلز گروه آهن در حالت یونی نقش مهمی را ایفا می کند، اما این خواص در حالت فلزی ممکن است هیچ مشارکتی نداشته باشند. با این حال، این احتمال وجود دارد که خواص فلزات گروه آهن در حالت فلزی ممکن است در رسوب Zn با Ni دخالت داشته باشند، زیرا همانطور که در ادامه توضیح داده می شود، این پدیده ویژگی اصلی ترسیب دوتایی القا شده که در آن خواص در حالت فلزی نقش مهمی ایفا می کند را نشان می دهد.
جدول 7 شرایط تجربی مورد استفاده را نشان می دهد. غلظت بسیار پایین Zn در حمام، در مقایسه با فلز گروه آهن، به منظور ترسیب دوتایی Zn تا حد امکان در نظر گرفته شد. دمای فرایند در بازه وسیعی از 5 تا 80 درجه سانتی گراد متغیر بود زیرا اورپتانسیل ترسیب فلزات گروه آهن به شدت به دما بستگی دارد و تقریبا در دمای بالا ناپدید می شود [10]. اگر چه آزمایشات با همه فلزات گروه آهن و Zn انجام شده است، اما فقط نتایج مربوط به سیستم Zn-Ni در اینجا آورده شده است، زیرا نتایج در کلیه سیستمهای آلیاژی روند مشابهی را نشان می دادند.
جدول 7 شرایط تجربی برای مطالعه ترسیب در زیر پتانسیل Zn همراه با فلزات گروه آهن
|
Operating condition
|
Bath composition
|
|
-0.6 — -1.37 vs Ag/AgCl
|
Catod Potential
|
0.025 mol/1
|
Zn sulfate
|
|
5-80 oC
|
Temperature
|
0.5 mol/l
|
Iron group metal sulfate
|
|
100 kC/m2
|
Amount of charge
|
⃰
|
Sulfuric acid
|
|
Quiescent bath
|
|
|
⃰ مقدار لازم جهت تنظیم pH در 3.0
شکل 19 منحنی پلاریزاسیون جزئی را برای ترسیب هر فلز از حمام تک فلزی مربوطه در دماهای مختلف را نشان می دهد. در تمام دماهای مورد مطالعه، ترسیب Zn در پتاسیل تعادلی خودش آغاز شد، اگرچه جریان حد برای ترسیب Zn با افزایش دما افزایش یافت. از سوی دیگر، در ترسیب نیکل، پتانسیل ترسیب که در 5 درجه سانتیگراد به شدت قطبی شده بود، در حدود 80 درجه سانتیگراد تقریبا به مقدار تعادلی خود بازگشت.
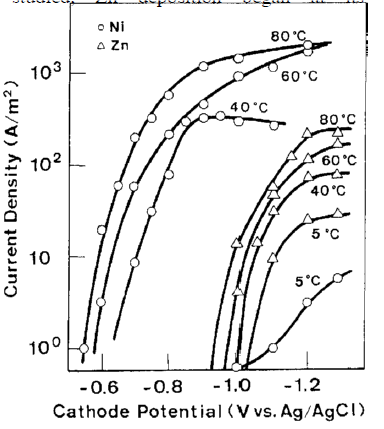
شکل 19 تاثیر دمای حمام بر روی منحنی های پلاریزاسیون Ni و Zn از محلولهای تک فلزی آنها
آلیاژهای Zn-Ni در دو درجه حرارت متفاوت، 40 و 80 درجه سانتیگراد بصورت الکتریکی ترسیب داده شدند. در دمای 40
درجه سانتیگراد، Ni همچنان اورپتانسیل ذاتی ترسیب قابل توجهی را نشان داد اما در دمای 80 درجه سانتیگراد، این اورپتانسیل ذاتی تقریبا ناپدید شد. مقایسه بین دانسیته جریانهای جزئی برای رسوب هر فلز از حمام تک فلزی مربوطه و همینطور از حمام آبکاری آلیاژی، در شکل های 20 و 21 به ترتیب در دماهای 40 و 80 درجه سانتیگراد نشان داده شده است.
با توجه به شکل 20، ترسیب نیکل به طور قابل ملاحظه ای در حمام آبکاری آلیاژی دچار افت شد، که این شکل به سادگی ویژگی اصلی ترسیب دوتایی غیر طبیعی را نشان داد. از سوی دیگر، رسوب Zn از حمام آبکاری آلیاژی در پتانسیلهای نجیبی که عموما هیچ رسوب Zn ای از حمام تک فلزی مربوطه امکان ترسیب ندارد رخ داده است. در نتیجه یک کاهش پتانسیل ترسیب برای Zn هنگام رسوب آلیاژ مشاهده شد. در 80 درجه سانتیگراد که در آن اورپتانسیل ذاتی ترسیب فلزات گروه آهن تقریبا ناپدید شد، نیکل در همان پتانسیلی که در حمام تک فلزی خود احیا می شود از حمام آبکاری آلیاژی شروع به احیاء شدن کرد و در این دما جریان برای کاهش پتانسیل ترسیب Zn شدیدا افزایش یافت.
همانطور که در شکل 22 نشان داده شده است، آنالیز طیف سنج الکترونی آگار بدست آمده از رسوبات در پتانسیلهای پایین تر از پتانسیل تعادل (-0.75 V vs. Ag/AgCl) و اورپتانسیل (-1.10 V vs. Ag/AgCl) وجود Zn فلزی را در هر دو رسوب مشخص کرد، و از طرفی هیچ مدرکی مبنی بر اینکه هیدروکسید Zn تشکیل شده در کاتد درون رسوب وارد شده باشد، وجود نداشت.
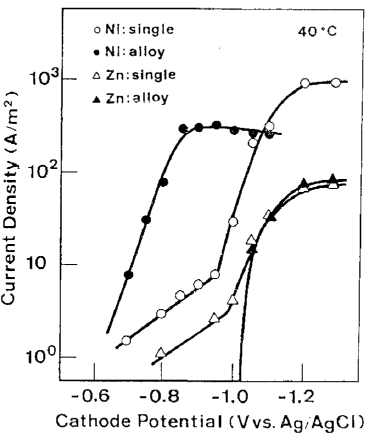
مقایسه بین منحنی های پلاریزاسیون جزئی Ni و Zn در طول آبکاری آلیاژی Zn-Ni و فلزات تنهای آنها در 40 درجه سانتی گراد.
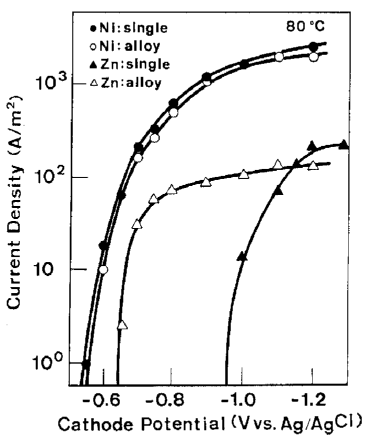
شکل 21 مقایسه بین منحنی های پلاریزاسیون جزئی Ni و Zn در طول آبکاری آلیاژی Zn-Ni و فلزات تنهای آنها در 80 درجه سانتی گراد.
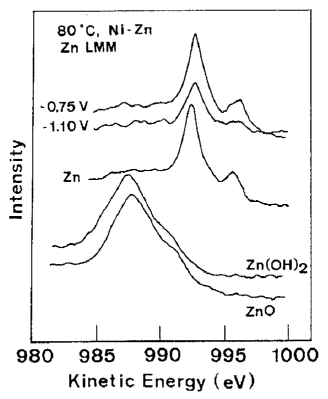
شکل 22 طیف الکترون آگار Zn (فرایند آگار LMM) در فلز خالص Zn(OH) , ZnO, Zn و رسوبات آلیاژی Zn-Ni
علاوه بر این، ترسیب الکتریکی آلیاژهای Zn با سایر فلزات در ارتباط با ترسیب Zn در پتانسیلی کمتر از پتانسیل تعادل آن مورد بررسی قرار گرفت. شکل 23، منحنی های قطبش جزئی برای احیای Zn از حمام های آبکاری آلیاژی Zn-Cd و Zn-Cu، Zn-Ni و حمام های Zn تنها را مقایسه می کند. بر اساس نتایج بدست آمده مشخص شد که منحنی های قطبش جزئی برای ترسیب Zn از حمام های آبکاری آلیاژی Zn-Cd و Zn-Cu نزدیک به نتایج مربوط به حمام Zn تنها بود.
همانطور که در بالا اشاره شد، احیای Zn در پتانسیل کمتر از پتانسیل تعادل ترسیب Zn تنها در حضور فلزات گروه آهن رخ داد و زمانی میسر شد که شرایط اجازه کاهش در اورپتانسیل ذاتی ترسیب فلزات گروه آهن را برای رسیدن به ترسیب ساده آنها داد. به نظر می رسد این شبیه همان پدیده ای است که بعنوان ترسیب دوتایی القا شده فلزات بی میل (فعال) که در آن خواص فلز گروه آهن در حالت فلزی نقش مهمی در ترسیب الکتریکی آلیاژها با بازده جریان قابل توجه ایفا می کنند [27]. با این حال، در ترسیب آلیاژی نوع القا شده، یون فلزی بی میل (فعال) می تواند به طور منطقی در حضور یک کاتالیزور به حالت فلزی احیا شود، زیرا نیروی محرکه ترمودینامیکی برای احیای آن وجود دارد. از سوی دیگر، احیای Zn در پتانسیلی کمتر از پتانسیل تعادل یون Zn در منطقه پتانسیلی رخ می دهد که هیچ نیروی محرکه ترمودینامیکی وجود ندارد. بنابراین، به نظر می رسد غیرممکن است که مکانیسم ترسیب آلیاژ نوع القا شده را مستقیما توسط اینکه نگاه داشته شدن هیدروژن اتمی بر روی فلز گروه آهن تازه ترسیب شده، باعث کاهش هیدروکسید Zn به Zn فلزی می شود، توضیح داد.
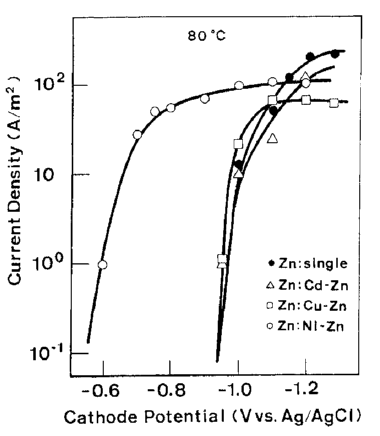
شکل 23 منحنی های پلاریزاسیون Zn در طول آبکاری Zn تنها، Zn, Cd-Zn, Cu-Zn و آلیاژهای Ni-Zn
در ترسیب الکتریکی بعضی فلزات بر روی بسترهای فلزی متفاوت، پتانسیل تعادل فلزی که قرار است رسوب داده شود به به شدت به سمت منطقه مثبت حرکت می کند، زیرا فعالیت فاز فلزی پیش از اینکه شروع به رسوب دادن کند صفر است. در نتیجه، در منطقه پتانسیلی که نجیبتر ازمقدار پتانسیل تعادل محاسبه شده تحت شرایطی که فعالیت فاز فلزی واحد است، ترسیب فلز حتی در یک مقدار بسیار کم باید ممکن باشد تا زمانی که فلز ترسیب یافته فعالیتی مطابق با پتانسیل داده شده نشان دهد. از آنجایی که مقدار فلز ترسیب یافته بسیار کم است لذا باید توسط آنالیز شیمیایی مورد شناسایی قرار بگیرد، عملا هیچ توده رسوب فلزی در منطقه زیر پتانسیل وجود ندارد. اگر ترسیب دوتایی فلز گروه آهن به موقعیتی برسد که اجازه بدهد فعالیت Zn ترسیب شده بطور مداوم بر روی سطح کاتد تشکیل شود تا در مقداری که بیش از مقدار پتانسیل داده شده نباشد نگه داشته شود، از نظر ترمودینامیکی توضیح مقادیر زیادی از رسوب در منطقه زیرپتانسیل که در شکل 21 نشان داده شده است ممکن خواهد شد.
همانطور که در بالا توضیح داده شد، به نظر می رسد خواص فلز گروه آهن در حالت فلزی باعث ترسیب Zn در منطقه زیر پتانسیل میشود، اگر چه این مکانیسم در حال حاضر کاملا مبهم است.
3. امکان سنجی برای توسعه فرایند آبکاری آلیاژی Zn-Ni.
3-1 شرایط کلی که آلیاژها را برای استفاده های کاربردی تولید می کنند.
همامطور که در بخش 2-4 توضیح داده شده است، مناطق II و III به علت بازده جریان بالایی که دارند برای پوششهای تجاری ترجیح داده می شوند. رابطه بین ترکیب آلیاژ و بازده جریان برای رسوب هر فلز یا آلیاژ از شکلهای 6، 7 و 8 بدست آمد و در شکل های 24 و 25 نشان داده شده است. در آلیاژهای با مقادیر کم نیکل که مربوط به منطقه II می شود، بازده جزئی جریان نیکل پایین بود و در محدوده باریکی از 5 تا 15 درصد قرار داشت، گرچه مقادیر بالای بازده جریان برای رسوب آلیاژ به علت بازده جریان جزئی Zn مشاهده شد. با افزايش مقدار نيکل آلیاژ، بازده جريان جزئي برای رسوب Zn به طور معکوس کاهش يافت، در حاليکه براي Ni افزايش يافت. این مسئله رسوب آلیاژ را با نرخ تقریبا ثابت و بازده جریان نسبتا بالا در منطقه III امکان پذیر می سازد.
در مناطق ترسیب دوتایی غیر طبیعی II و III، همانطور که قبلا ذکر شد، Zn نسبت به نیکل به عنوان فلز نجیبتر رفتار می کند و با افزایش دانسیته جریان، رسیدن رسوب Zn به جریان حد خود نسبت به Ni در اولویت است. هنگامی که جریان حد برای رسوب نیکل به دست می آید، ترکیب آلیاژ با حمام (CRL) مشابه می شود، زیرا هر دو جریان حد برای رسوب فلز به دست می آیند. بنابراین میزان محتوای نیکل آلیاژ به وسیله % فلز Ni در حمام داده می شود. با این وجود، همانطور که در شکل های 24 و 25 نشان داده شده است، این میزان محتوای نیکل به ویژه در حمامهای با غلظت کم یون Zn (حمامهای 14، 15، 16)، به دلیل کاهش سریع بازده جریان به طور عمده ناشی از ترسیب پوشش پودری در منطقه IV است در عمل به ندرت حاصل می شود. از نمودارهای 24 و 25 مشخص شد که بازده جریان برای ترسیب آلیاژ هنگامی که بازده جریان جزئی Zn افت می کند تا با افزایش بازده جریان جزئی نیکل یکسان شود، به طور ناگهانی کاهش می یابد. این به این معنی است که جریان ترسیب Ni به سرعت افزایش پیدا می کند تا مشابه جریان ترسیب Zn شود و همین امر هنگامی که رسوب Zn به جریان حد خود می رسد منجر به پودری شدن رسوبات می شود. هنگامی که جریانهای رسوب هر دو فلز یکسان هستند، ترکیب آلیاژ باید همانند CRL حمام حاوی مقادیر اکی مولار هر یون فلزی باشد. ترکیب آلیاژ در این نقطه (3/47٪ Ni) است که به نظر می رسد حداکثر مقدار نیکل آلیاژ قابل دسترس با بازده جریان قابل قبول باشد.
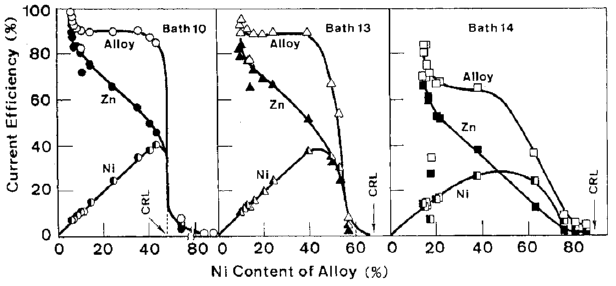
شکل 24 ارتباط بین ترکیب آلیاژ و بازده جریان در حمامهای 10، 13، 14 (جدول 4 را ببینید).
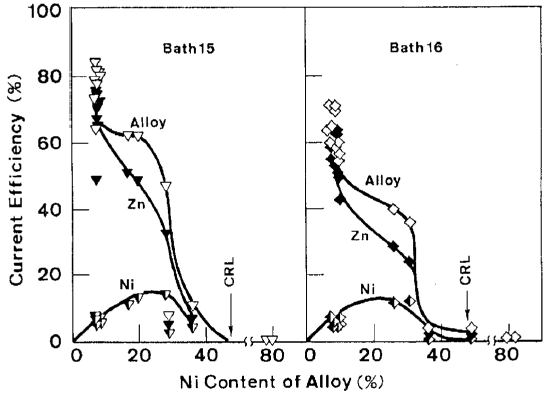
شکل 25 ارتباط بین ترکیب آلیاژ و بازده جریان در حمام های 15 و 16
همانطور که در بالا ذکر شد، آلیاژهای با محتوای Ni نسبتا بالا می توانند با بازده جریان قابل ملاحظه ای در منطقه III بدست آیند. با این حال، منطقه II بیشتر مطلوب است، زیرا ترکیب آلیاژی به سختی در گستره وسیعی از دانسیته های جریان تغییر می کند (در گستره وسیعی از دانسیته جریان ثابت است). بیشترین مقاومت در برابر خوردگی آلیاژهای Zn-Ni مربوط به زمانی است که میزان نیکل آلیاژ 10 تا 16 درصد باشد و صرفا شامل فاز گاما باشد [38]. اگر چه مقدار نیکل آلیاژها در منطقه II کم است، اما با ثابت نگاه داشتن غلظت یون Zn در سطح نسبتا بالا و با افزایش %Ni در حمام آلیاژی میتوان میزان نیکل آلیاژ را در این منطقه افزایش داد[39].
منطقه II توسط دانسیته جريان گذار و دانسیته جريانی که ترسیب Zn در آن آغاز می شود احاطه شده است. دانسیته جریان گذار همانگونه که در 2-3-3 استنتاج شد بصورت یکنواخت توسط ظرفیت بافر حمام تعیین می شود، در حالی که دانسیته جریانی که در آن رسوب Zn شروع به رسیدن به جریان حد خود می کند بستگی به درجه احیای یون Zn در لایه کاتد دارد. بنابراین، منطقه II در شرایطی که احیای شدید یون هیدروژن و احیای کم یون Zn در لایه انتشار کاتد افزایش می یابد، گسترش می یابد.
علاوه بر ترکیب آلیاژ و بازده جریان که بعنوان مهمترین عوامل در نظر گرفته می شوند، ظاهر سطح پوشش، ثبات و قدرت پرتاب حمام، انرژی و یا بازده ولتاژ برای آبکاری و رفتار انحلال آندی آندهای فلزی نیز در طراحی صنعتی اهمیت دارند. با توجه به همه این عوامل، ترسیب الکتریکی آلیاژها بر اساس بحث فوق در مورد شرایط تولید آلیاژها برای استفاده های کاربردی انجام شد. نتایج و بحثهای مربوطه در زیر آمده است.
3-2. ترسیب الکتریکی آلیاژها از حمام سولفاتی
3-2-1 تاثیر pHدر پهن تر شدن منطقه IIدر حمام سولفاتی ساده که فاقد اسید آلی است.
دانسیته جريان گذار در حمامی که ظرفيت بافر پايينتری دارد کمتر است و منجر به گسترده تر شدن دامنه چگالي جريان در ناحیه II می شود. شکل 26 ویژگیهای pH بافری در حمام آلیاژی استاندارد (حمام 10 در جدول 4) را هنگامی که PH اولیه تغییر می کند نشان می دهد. همانطور که از این شکل مشخص است، تفکیک H2SO4 به SO4-2 (pK = 1.99) واکنش بافری اصلی در حمام سولفاتی است. شکل 27 اثر pH حمام بر رفتار رسوب آلیاژی را زمانی که سدیم استات از حمام 10 حذف می شود، با استفاده از شرایط آبکاری شرح داده شده در شکل 2-4 نشان می دهد. همانطور که از این شکلها مشهود است، دانسیته جریان گذار کاهش می یابد و در نتیجه آن پهنای منطقه II در حمام هایی با pH بالاتر افزایش می یابد، زیرا افزایش pH به طور قابل توجهی ظرفیت بافری حمام را کاهش می دهد. در حمام با pH 4.5، منطقه I بدلیل دانسیته جريان گذار خیلی کم ناپدید شد و در این محدوده تنها آلیاژهایی که ترکيب آنها (12٪ نيکل) و دارای ترکیب فاز گاما هستند به طور کامل در منطقه II به دست آمدند.
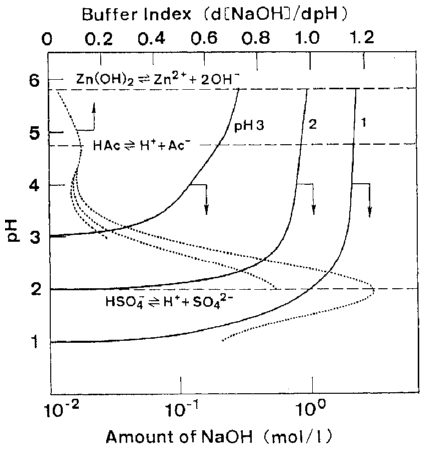
شکل 26 منحنی تیتراسیون نظری و شاخص های بافر هنگامی که PH اولیه در حمام 10 تغییر می کند.
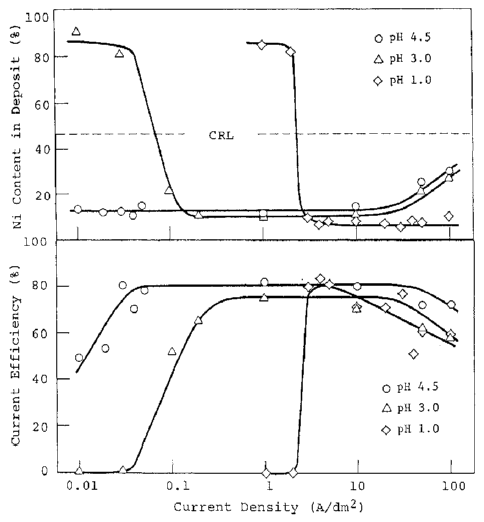
شکل 27 تاثیر دانسیته جریان بر روی میزان نیکل پوشش و بازده جریان کاتد برای ترسیب آلیاژ از حمام سولفاتی با مقادیر مختلف pH.
3-2-2. پوشش های طولانی مدت.
در مطالعات رسوبدهی آلیاژ Zn-Ni که در بخش های قبلی ارائه شده است، پوشش کوولوستاتیک در 10 C/cm انجام شد. با این مقدار بار پوششی با ضخامت 5 میکرون را بدست می آید که به طور معمول در صنایع تولید ورق فولاد آلیاژی توسط تولیدکنندگان فولاد پذیرفته شده است. از سوی دیگر، در پوشش تجاری اجزای کوچک، فیلم ضخیم تر، حدود 15 پیکنومتر، مورد نظر است. ترکیب آلیاژ با طولانی تر شدن مدت زمان فرایند الکترولیز طولانی تغییر می کند و همین امر باعث ایجاد مشکلاتی می شود.
بنابراین، آلیاژها در دو مقدار مختلف بار الکتریکی (C/cm 10 و 30) از همان حمام pH 4.5 که در مطالعات پوشش در شکل 27 مورد استفاده قرار گرفته بود، ترسیب داده شدند. رفتار رسوب آلیاژ در دو مورد در شکل 28 مقایسه شده است. از این شکل به وظوح مشخص است که تغییرات در ترکیب آلیاژ و بازده جریان بعد از الکترولیز طولانی مدت در منطقه II ناچیز است.
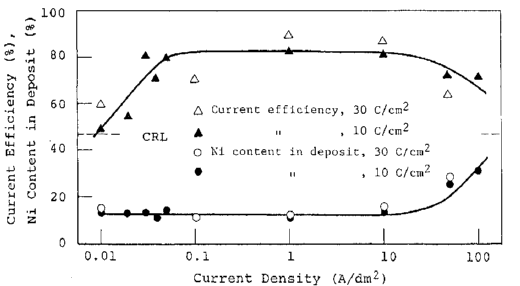
شکل 28 تاثیر مدت زمان الکترولیز بر ترکیب آلیاژ و بازده جریان کاتد برای ترسیب آلیاژ در دانسیته جریانهای مختلف.
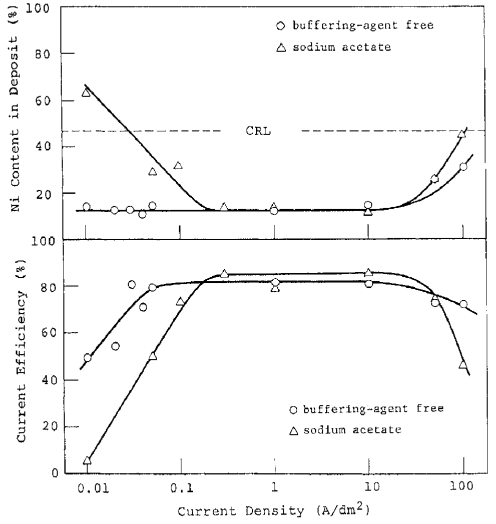
شکل 29 تاثیر سدیم استات بر ترکیبات آلیاژ و بازده جریان کاتد برای ترسیب آلیاژ.
3-2-3. ترسیب الکتریکی (آبکاری) از حمام های حاوی اسیدهای آلی یا معدنی.
همانطور که در شکل 28 نشان داده شده است، آلیاژهای با ترکیب پایدار می توانند از حمامهای با pH 4.5 در طیف وسیعی از دانسیته جریان بدست آیند. با این حال، حمامی که pH بالایی دارد ممکن است به راحتی از هیدرولیز یون های فلزی رنج ببرد. از این رو، برخی از اسیدهای آلی یا معدنی که به صورت عامل بافر یا عوامل کمپلکس دهنده عمل می کنند می توانند به حمام اضافه شوند تا پایداری حمام بالا برود. این اسید ها همچنین می توانند هدایت حمام را برای کاهش ولتاژ سل افزایش دهند.
آلیاژها در حمامهایی با pH 4.5 که حاوی 0.5 مول بر لیتر از هریک از یونهای فلزی و اسیدهای آلی یا معدنی به فرم سدیم استات، سدیم سیترات، بوریک اسید یا سوکسینیک اسید بودند، ترسیب داده شدند. غلظت این اسید ها برای سوکسینیک اسید 0.25 مول بر لیتر و برای سایر اسیدها 0.5 مول بر لیتر بود. پایین تر بودن غلظت سوکسینیک اسید به دلیل حلالیت کم آن می باشد. مقدار بار برای الکترولیز 10 C/cm بود. رفتار رسوب آلیاژ در هر حمام در شکل های 29 و 30 خلاصه شده است. شکل 29 همچنین دارای منحنی های مربوطه برای یک حمام عاری از اسید آلی است که از شکل 28 برای مقایسه استفاده می شود.
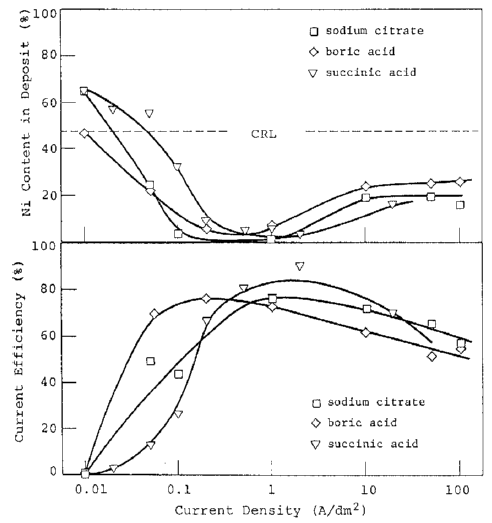
شکل 30 تاثیر سدیم سیترات، بوریک اسید یا سوکسینیک اسید بر ترکیبات آلیاژ و بازده جریان کاتد برای ترسیب آلیاژ.
افزودن این اسیدها احتمالا به علت افزایش ظرفیت بافری یا افزایش pH بحرانی برای ترسیب هیدروکسید فلزی به علت تشکیل کمپلکس فلزی باعث افزایش دانسیته جريان انتقال شد. هنگامی که حمام حاوی سدیم سیترات، بوریک اسید یا سوکسینیک اسید است (شکل 30)، بخش افزایش یافته منحنی محتوای نیکل (منطقه III) نیز به سمت چپ منتقل شد و به باریکتر شدن منطقه II منجر شد. علاوه بر این، محتوای نیکل آلیاژهای به دست آمده در منطقه II تا حدی کاهش یافت که هیچ فاز گامای منفردی تشکیل نشد. همانطور که در شکل 26 نشان داده شده است، در حمام با pH 4.5، تفکیک استیک اسید (pK = 4.74) واکنش بافری اصلی است و محلول دارای بیشترین مقاومت در برابر تغییر pH در pH 4.74 است که کمی کمتر از مقدار بحرانی برای رسوب هیدروکسید روی می باشد. از اسیدهای مورد بررسی، بنابراین، از بین اسیدهای مورد استفاده مشخص شد که سدیم استات نمی تواند بعنوان عامل کمپلکس کننده استفاده شود ولی بدلیل اینکه بعنوان یک عامل بافری کننده عمل می کند، بیشترین اهمیت را دارد زیرا مقدار نسبتا کمی از آن می تواند بدون تاثیر خیلی زیادی بر عرض منطقه II، تا حدی شرایط وان را ثابت نگاه دارد.
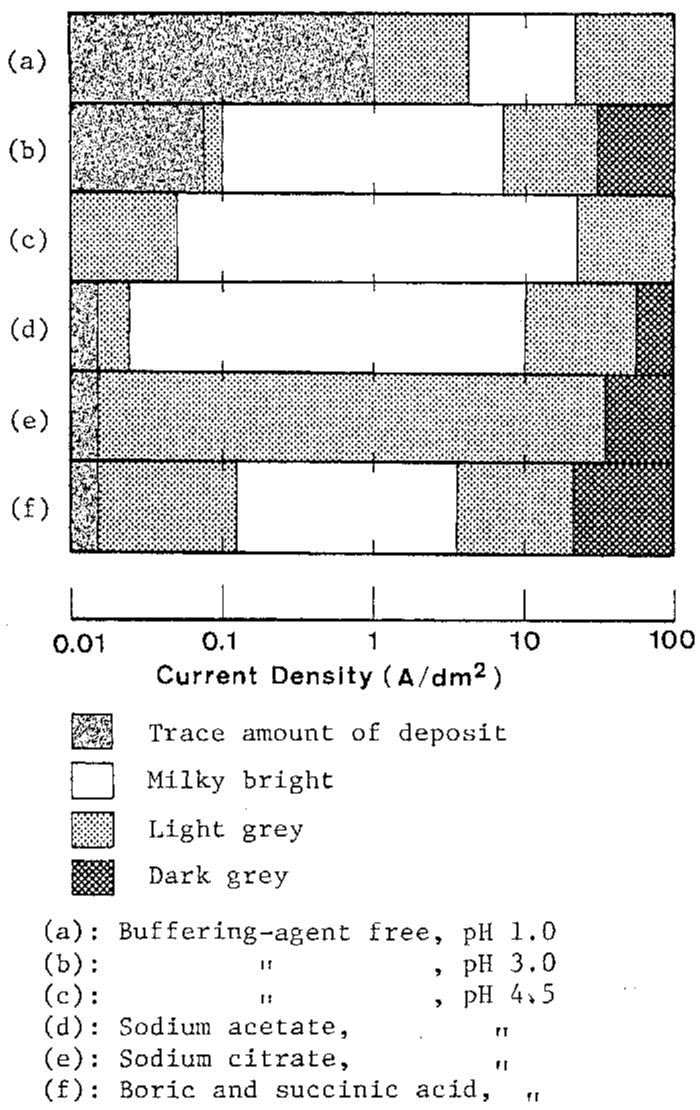
شکل 31 نمایش شماتیک ظاهر رسوبات بدست آمده از انواع مختلف حمام های سولفاتی
3-2-4. ظاهر سطحی پوشش.
شکل ظاهری آلیاژهای ترسیب داده شده از حمام های آبکاری سولفاتی مختلف که در اینجا مورد بررسی قرار گرفته است، خلاصه شده و به صورت شماتیک در شکل 39 به صورت تابعی از دانسیته جریان ارائه شده است. عکس 1 در شکل 31 ظاهر معمولی را در هر منطقه از دانسیته جریان نشان می دهد.
به طور کلی، رسوبات شیری رنگ براق در منطقه II بدست می آیند که در آن ترسیب آلیاژ غیر طبیعی با بازده جریان بالا ادامه می یابد. با افزایش دانسیته جریان، ظاهر رسوبات به تدریج از براق(منطقه III) به خاکستری تیره (منطقه IV) تغییر می کند. از این رو رسوبات با ظاهر سطحی رضایت بخش تنها در منطقه II به دست می آیند، و در هر دو نوع حمام های حاوی یا فاقد اسیدهای آلی یا سدیم استات، رسوبات مطلوبی را در گستره وسیعی از دانسیته جریان تولید می کنند.

عکس 1 شکل ظاهری رسوبات
3-3. ترسیب آلیاژ از حمام کلریدی.
3-3-1 رفتار ترسیب و ظاهر سطح آلیاژها.
حمام سولفاتی که اساسا مخلوطی از محلول های سولفات فلزی است، در تولید ورقهای فولادی آبکاری شده آلیاژی Zn-Ni توسط تولید کنندگان فولاد مورد استفاده قرار گرفته است. این حمام آبکاری تجاری، بدلیل عملیات پیوسته با سرعت بالا در دانسیته جریان بالا و با توجه به بازده تولیدی که دارد، مورد پذیرش قرار گرفته است، اما کنترل شدید شرایط عملیاتی در این نوع حمام ضروری است. بنابراین، آبکارهایی که در اشل کوچکی کار میکنند ترجیح می دهند از سایر حمامها برای موارد کاربردی استفاده کنند. آلیاژهای Zn-Ni حاوی 5 - 85٪ نیکل (ترجیحا 10-20٪ نیکل) را می توان از حمام های سیانیدی، آمونیاکی، پیرو فسفاتی و زینکات قلیایی و از حمام های با اسیدیته ضعیف مانند سولفات/ سولفامات، کلریدی یا برپایه استات به دست آورد.
حمام های قلیایی به خصوص برای به دست آوردن آلیاژهای غنی از Zn استفاده می شود در حالی که حمام های اسیدی مانند سولفاتی و کلریدی به طور عمده برای به دست آوردن آلیاژ های غنی از Zn و همچنین غنی از Ni استفاده می شوند [40].
از بین این حمام های آبکاری Zn-Ni، حمام کلریدی برای مطالعه بیشتر انتخاب شد زیرا به نظر می رسد این حمام دارای خواص مطلوبی برای اعمال پوشش در اشل تجاری از جمله انحلال خوب آندها و هدایت بالا برای تولید با بازده بالای انرژی است.
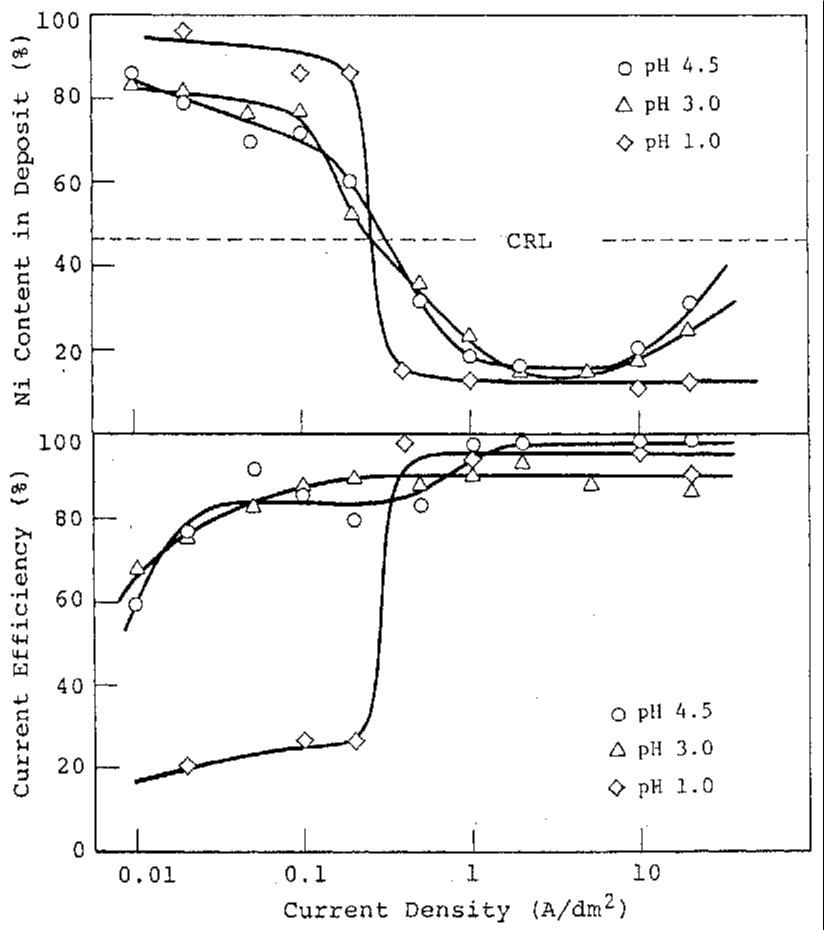
آلیاژها در دانسیته جریانهای مختلف در یک حمام ساده کلریدی حاوی 0.5 مول بر لیتر از هریک از فلزها (Zn و Ni) آبکاری شدند. pH محلول با اسید هیدروکلریک 1.0، 3.0 یا 4.5 تنظیم شد. شرایط عملیاتی مشابه موارد 2-4 یا 2-3-1 است. رفتار رسوب آلیاژ و ظاهر سطح پوشش ها به ترتیب در شکل های 32 و 33 نشان داده شده است.
در همه حمام هایی که مورد بررسی قرار گرفتند ، همانطور که در شکل 32 نشان داده شده است، انتقال از نوع عادی به نوع غیر طبیعی تقریبا در همان چگالی جریان، A/dm2 0.2 رخ می دهد، که نشان دهنده وابستگی کم دانسیته جریان گذار به pH حمام است. در دانسیته جریانهای بالای جریان انتقال، آلیاژهایی با محتوای نیکل تقریبا ثابت از 10 تا 15 درصد با بازده جریان بالا در حمامی با pH 1.0 ترسیب داده شدند که این همان روندی بود که در حمام سولفاتی دیده شد. از سوی دیگر، وقتی pH به 3.0 و 4.5 افزایش یافت، محتوای نیکل به طور قابل ملاحظه ای از 15 تا 40 درصد تغییر کرد، اگرچه بازده جریان نسبتا بالایی حتی در ترسیب دوتایی نرمال در منطقه I مشاهده شد.
همانطور که در شکل 33 نشان داده شده است، پوشش براق شیری هنگامی که آلیاژها حاوی 10-20٪ نیکل هستند به دست می آید. با تجاوز % نیکل از 20 درصد، ظاهر سطح پوشش خاکستری شد.
دانسیته جریان است که به ترسیب آلیاژهای روشن شیری متشکل از فاز گاما منجر می شود.
شکل 32 تاثیر دانسیته جریان بر روی میزان نیکل در رسوبات و بازده جریان کاتد برای ترسیب آلیاژ از حمام کلریدی با مقادیر pH مختلف.
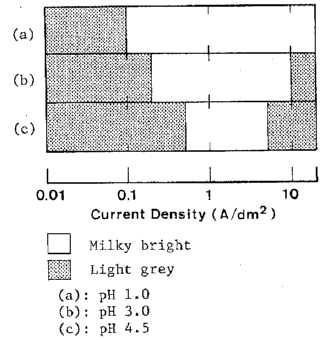
شکل 33 نمایش شماتیک ظاهر رسوبات بدست آمده از حمام های کلریدی با مقادیر pH مختلف
3-3-2 مقایسه با حمام سولفاتی.
در تلاش برای به دست آوردن آلیاژها برای کاربردهای عملی، از حمام های سولفاتی و کلریدی، مشخص شد که حمام ساده سولفاتی با pH 4.5 و حمام ساده کلریدی با pH 1.0 ارجح هستند. رفتار رسوب آلیاژهای این دو حمام در شکل 4 مقایسه شده است. محدوده دانسیته جریانی که به یک آلیاژ با ترکیب پایدار و با بازده جریان بالا می رسد در حمام سولفاتی گسترده تر از حمام کلریدی است، زیرا دانسیته جریان گذار در حمام سولفاتی بسیار کم است. با این حال، هنگامی که حمام کلریدی با حمام سولفاتی حاوی سدیم استات مقایسه می شود (شکل 29)، حمام کلریدی ترجیح داده می شود، زیرا در حالیکه دانسیته جریانهای گذار مشابهی دارند اما بازده جریان آن بالاتر است.
رفتار رسوب آلیاژ در یک حمام کلریدی از دو منظر با آنچه که در حمام سولفاتی است تفاوت دارد: تراکم جریان گذار تقریبا مستقل از pH حمام است. و بازده جریان برای رسوب آلیاژ در منطقه ترسیب دوتایی نرمال بسیار بالاتر است.
علیرغم مشابه بودن pH حمامها، در حمام کلریدی دانسیته جریان گذار در یک دانسیته جریان بالاتری نسبت به حمام سولفاتی رخ داد که در شکل 34 نشان داده شده است. این احتمالا ناشی از افزایش pH بحرانی برای ترسیب زینک هیدروکساید بود. از آنجاییکه در اینجا حمام های کلرایدی مورد بررسی قرار گرفتند که فاقد هرگونه عامل بافری کننده pH بودند، تغییر در ظرفیت بافری در هنگام تغییرات PH حمام کوچک بود. بنابراين دانسیته جريان انتقال به ندرت از PH حمام متاثر شد.
در بحثهایی که تاکنون در مورد رسوب آلیاژ از حمام سولفاتی ارائه شده است، هیچ اشاره ای به وضعیتی که در آن به کاهش اورپتانسیل ترسیب ذاتی بزرگ فلز گروه آهن در حضور یک کاتالیزور توجه شده باشد، نشده است. مشخص شده است که یون کلر به عنوان یک کاتالیزور برای ترسیب نیکل عمل می کند [41]. بنابراين، ترسیب دوتایی غیر طبیعی با مشكلاتی همراه خواهد بود، در حاليكه پتانسيل ترسیب نيكل در حضور مقدار زيادی از يون كلريد تقريبا برابر مقدار تعادلي آن است. این مسئله قبلا در بخش 2-5-4 ذکر شده است که زمانی که شرایط برای ترسیب نیکل در اورپتانسیل ذاتی کم، مهیا باشد ترسیب Zn همراه با نیکل در پتاسیل کمتر از پتانسیل تعادل با بازده جریان نسبتا بالایی اتفاق می افتد. بنابراین، افزایش دما یا وارد شدن یون کلر به حمام منجر به رسوب آلیاژی نوع معمولی با بازده جریان نسبتا بالا می شود.
3-4 رفتار انحلال آندها در هر دو حمام سولفاتی و کلریدی.
3-4-1 بازده انحلال آندهای فلز محلول.
در مواردی که از آند نامحلول برای آبکاری استفاده می شود، خروج گازهایی مانند اکسیژن یا کلر به طور معمول در پتانسیلهای بسیار نجیب رخ می دهد، که منجر به کاهش بازده انرژی به دلیل ولتاژ زیاد پیل می شود، که نهایتا احیای یون های فلزی حمام در فرایندهای بلند مدت را با مشکل مواجه میسازد. برای جلوگیری از این مشکلات، فلزی که بناست آبکاری شود باید بعنوان آند محلول استفاده شود. با این حال، در آبکاری آلیاژی با ترکیب % مشخص اجزا، بازده جریان جزئی برای ترسیب هر فلز قطعا کمتر از 100٪ است. زمانی که شارژ یکی از اجزا توسط آند محلول مربوطه انجام می گیرد و شارژ ماده دوم از طریق افزودن مواد شیمیایی مناسب صورت می گیرد، این منجر به کاهش تدریجی غلظت یکی از اجزای تشکیل دهنده و افزایش غظت سایر گونه یا گونه ها می شود. از این رو در این مطالعه، یک جفت سیستم آندی متشکل از هر دو جزء برای آبکاری آلیاژی Zn-Ni و بازده انحلال آندی مورد بررسی قرار گرفت. ترکیبات حمام و شرایط کار در جدول 8 نشان داده شده است. در سیستم جفت شده آندی متشکل از Zn و Ni، هر آند برای اینکه به طور مستقل دانسیته جریان آندی اعمال شده را کنترل کند به یک مقاومت متغیر تجهیز شد. Zn خالص، نیکل خالص و نیکل حاوی 0.02٪ S تولید شده توسط Sumitomo Metal Mining Co.، Ltd. (علامت تجاری: SK نیکل) به عنوان آند مورد استفاده قرار گرفتند و بازده انحلال با اندازه گیری کاهش وزن هر یک از آندها تعیین شد.
جدول 8 شرایط آزمایشگاهی برای اندازه گیری بازده جریان آند
|
Operating condition
|
Bath composition
|
|
|
Sulfate bath
|
|
Current density 0.4-50A/dm2
|
Zinc sulfate 0.5 mol/l
|
|
Temperature 40oC
|
Nickel sulfate 0.5 mol/l
|
|
Anods Zn, pure Ni, S-containing Ni
|
pH 4.5
|
| |
Chloride bath
|
|
Catod Cu
|
Zinck chloride 0.5 mol/l
|
| |
Nickel chloride 0.5 mol/l
|
|
Quescent bath
|
pH 4.5
|
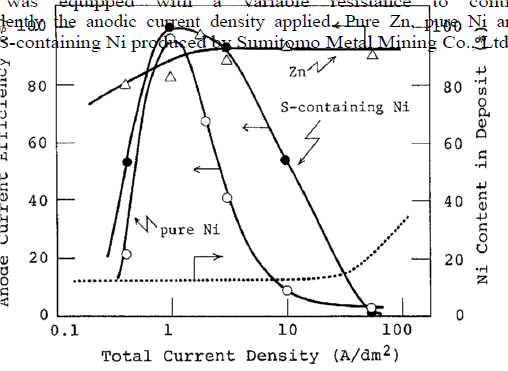
شکل 35 تاثیر دانسیته جریان بر بازده جريان آند Zn، نيکل خالص Ni و Ni حاوی S در حمام سولفاتی.
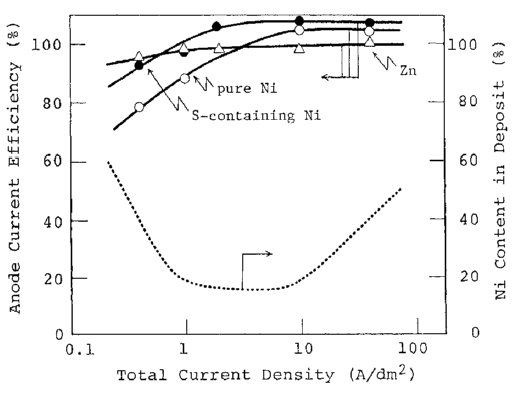
شکل 36 تاثیر دانسیته جریان بر روی بازده جریان آند Zn، نيکل خالص Ni و Ni حاوی S در حمام کلریدی
شکل های 35 و 36 بازده انحلال آند در دانسیته جریانهای مختلف کاتدی در حمام های سولفاتی و کلریدی را نشان می دهند. تغییر ترکیب آلیاژ توسط خطوط نقطه چین در این شکل ها نشان داده شده است. در این آزمایش، دانسیته جریان کامل آند مطابق با ترکیب آلیاژی مربوطه به هر آند توزیع می شود تا تغییرات غلظت هر یون فلزی در حمام به حداقل برسد. برای مثال، هنگامی که آلیاژ حاوی 10٪ نیکل است، نسبت دانسیته جریان جزئی کاتدی Ni به Zn به 1: 9 است. پس، 10٪ از جریان کل آندی به نیکل و 90٪ به Zn اعمال می شود. علاوه بر این، بازده جریان آندی هر آند در این شکلها بر اساس این فرض که وقتی که جریان اعمال شده به هر آند صرف انحلال فلز شود بازده جریان 100٪ شود ، محاسبه شد. در حمام سولفاتی، همانطور که در شکل 35 نشان داده شده است، بازده انحلال Zn حدودا 80٪ در منطقه با دانسیته جریان کم زیر 1 A/dm2 بود و به تدریج با افزایش دانسیته جریان افزایش می یابد.آندهای نیکل خالص و حاوی گوگرد حداکثر بازده انحلال حدود 100٪ را در 1A/dm2 نشان دادند. در نتیجه کاهش یا افزایش دانسیته جریان از این مقدار مطلوب منجر به کاهش شدید بازده انحلال شد. کاهش بازده انحلال در دانسیته جریانهای بالاتر باید به پسیو شدن آند مربوط شود، گرچه دلیل کاهش بازده در دانسیته جریانهای پایین در حال حاضر مبهم است. در حمام های کلریدی، همانطور که در شکل 36 نشان داده شده است، Zn با راندمان حدود 100٪ در بیش از محدوده دانسیته جریان بررسی شد. بازده انحلال آند نیکل خالص و حاوی S با افزایش دانسیته جریان افزایش یافته و در دانسیته جریانهای بالاتر از 2 A/dm2 بیش از 100 درصد است. در حمام های کلریدی، هیچگونه کاهش در بازده انحلال نیکل در دانسیته جریانهای بالا مشاهده نشد، زیرا یون Cl مانع از پسیو شدن Ni می شود. بازده انحلال کمی برای Ni حاوی S بیشتر از Ni خالص بود، که مشابه روندی است که در حمامهای سولفاتی مشاهده شد.
3-4-2. ترسیبNi بر روی آندهای محلولZn
در ترسیب الکتریکی آلیاژهای Zn-Ni با استفاده از آند های محلول Zn، ترسیب آلیاژ کاتدی در منطقه II در پتانسیل هایی که نسبت به پتانسیل تعادل Zn تا حدودی کمتر نجیب هستند اتفاق می افتد، در حالی که انحلال آندی Zn در پتانسیل هایی که نسبتا نجیبتر از پتانسیل تعادل Zn هستند، ادامه می یابد. با توجه به اینکه Zn دارای پتانسیل تعادلی کاملا منفی است، Ni می تواند همانطور که بر روی کاتد احیا می شود بر روی آند Zn نیز احیا شود.
برای بررسی این موضوع، آند روی بعد از اتمام فرایند آبکاری گالوانوستاتیک ( A/dm21 و 10) و الکترولیز کولواستاتیک با استفاده از سیستم آند جفت شده (100 C/cm) با هیدروکلریک اسید حل شد، و Ni محلول حاصل برای تایید ترسیب Ni مورد آنالیز قرار گرفت. در جدول 9 نتایج برای دو آند مختلف نیکل؛ Ni خالص و نیکل حاوی S نشان داده شده است. جدول همچنین شامل بازده انحلال ظاهری و تصحیح شده Zn است.
مقدار نیکل ترسیب یافته بر روی آند تقریبا مستقل از نوع آند نیکل است، که نشان می دهد جایگزینی رسوب Ni بر روی Zn تحت تاثیر نوع آند نیکل قرار نگرفته است.
جدول 9 مقدار نیکل ترسیب یافته بر روی آند Zn و اصلاح بازده جریان ظاهری آند برای رسوب Zn.
|
Sulfate bath
|
|
Corrected anode
current eff. Of Zn(%)
|
Apparent anode
current eff. Of Zn (%)
|
Amount of deposited
Ni on Zn anode (mg/Cm2)
|
Current
density (A/dm2)
|
|
85.4*
83.7**
|
83.6*
82.0**
|
0.616*
0.578**
|
1
|
|
97.7*
91.2**
|
96.6*
90.0**
|
0.316*
0.399**
|
10
|
|
Chloride bath
|
|
Corrected anode
current eff. Of Zn(%)
|
Apparent anode
current eff. Of Zn (%)
|
Amount of deposited
Ni on Zn anode (mg/Cm2)
|
Current
density (A/dm2)
|
|
101.6*
102.7**
|
98.2*
98.7**
|
1.16*
1.39**
|
1
|
|
103.0*
100.3**
|
98.8*
96.7**
|
1.43*
1.35**
|
10
|
⃰ Ni خالص
⃰⃰⃰ ⃰ Ni حاوی S
همانطور که در جدول 9 نشان داده شده است، پوشش نیکل از 0.3-0.6 میلی گرم بر سانتی متر مربع در حمام سولفاتی و 1.2 - 1.4 میلی گرم بر سانتی متر مربع در حمام کلریدی بر روی آند Zn مشاهده شد. بنابراين، بازده واقعی انحلال Zn در حمام سولفاتی 1 تا 2 درصد بالاتر و در حمام کلریدی 3 تا 4 درصد بیشتر از مقدار ظاهری است. بنابراین، مقدار نیکل بیشتری در طول ترسیب آلیاژ در حمام کلریدی نسبت به حمام سولفاتی بر روی آند Zn رسوب می کند. با توجه به اینکه ترسیب نیکل بر روی هر دوی کاتد و آند حوالی پتانسیل تعادلی Zn در حضور مقادیر زیادی از یونهای Zn اتفاق می افتد، رفتار رسوب Ni روی آند Zn باید به روش مشابه با رسوب کاتدی آن توضیح داده شود. در طی ترسیب آلیاژ در منطقه I، همانطور که در 3-3-2 ذکر شد، مقدار نیکل ترسیب یافته بر روی کاتد در یک حمام کلریدی نسبت به یک حمام سولفاتی بیشتر است که با رفتار رسوب نیکل بر روی آند Zn مطابق است. بنابراين، ويژگيهايي که خاص فلزات گروه آهن هستند منجر به واکنش در آند Zn مي شوند.
همانطور که قبلا در این بخش ذکر شد، از منظر بازده انحلال آندی، هنگامی که از آند محلول Zn استفاده می شود، حمام کلریدی نسبت به حمام سولفاتی ترجیح داده می شود تا تغییر ترکیب حمام به حداقل برسد. با این حال، ترسیب نیکل بر روی آند Zn اتفاق می افتد که ممکن است از روی آند جدا شود و به سمت خط و خش موجود برروی سطح آبکاری شونده روان شود. به نظر می رسد در حمام آبکاری سولفاتی و بویژه در حمام کلریدی، یک کیسه آند که از معلق شدن ذرات نیکل ممانعت کند ضروری باشد.
4. ساختار و رفتار خوردگی پوشش های آلیاژی Zn-Ni.
ساختار فیلمهای آلیاژی Zn-Ni حاصل از یک حمام سولفاتی مورد مطالعه قرار گرفته است. فیلم های آلیاژی در حمامهایی با pH 3.0 یا 4.5، دریک دانسیته جریان ثابت کاتدی، یا دانسیته جریانهای پیوسته درحال تغییر ترسیب شدند. برای به دست آوردن یک دامنه از دانسیته جریانهای پیوسته درحال تغییر، از یک هول سل استفاده شد. ساختار توسط پراش اشعه ایکس بررسی شد و مورفولوژی و ترکیب سطح با استفاده از SEM و EPMA مورد بررسی قرار گرفت.
برای درک خواص بنیادی خوردگی فیلم های آبکاری شده، رفتار خوردگی فیلمها بدون هرگونه تاپ کوتی در محلول های آبی مورد بررسی قرار گرفت.
4-1. ساختار فیلم های آبکاری شده
برای نمونه هایی که با استفاده از یک توزیع دانسیته جریان هول سل تهیه می شوند، محتویات Ni و Zn، ترکیب آلیاژ و ضخامت فیلم های ترسیب یافته به عنوان تابعی از فاصله از لبه دانسیته جریان بالای نمونه در شکل 37 نشان داده شده است. ضخامت فیلم ترسیب یافته با دانسیته جریان تغییر می کند، اما غلظت Ni با تغییر در دانسیته جریان تغییر زیادی نمی کند. ظاهر سطح فیلم ترسیب یافته از حمام با pH 3.0 در عکس 2 نشان داده شده است. در منطقه با دانسیته جریان بالا، پوشش ظاهر نامنظم خوبی دارد. در منطقه با دانسیته جریانA/dm25-15، به نظر می رسد پوشش گرانولی، و اندازه دانه ها با کاهش دانسیته جریان کاهش می یابد.
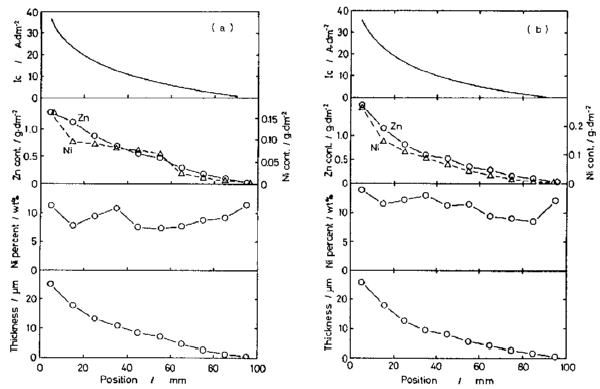
شکل 37 توزیع دانسیته جریان، محتویات Zn و Ni، ترکیب آلیاژ و ضخامت فیلم رسوب شده را به عنوان تابعی از فاصله از لبه بالای دانسیته جریان نمونه. (a) حمام در pH 3.0، (b) حمام در pH 4.5.
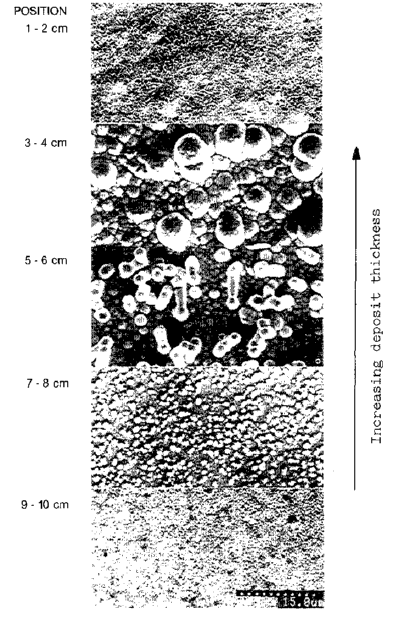
عکس 2. ظاهر سطح فیلم که در یک هول سل ترسیب یافته است؛ تغییر موقعیت مربوط به تفاوت در دانسیته جریان
توزیع نیکل و Zn در سطح توسط EPMA مورد بررسی قرار گرفت، و نتیجه در عکس 3 برای فیلم ترسیب شده با دانسیته جریان حدود A/dm2 10نشان داده شده است. توزیع دو بعدی Ni و Zn همگن بود. توزیع عمقی عناصر آلیاژی نیز بر روی سطح مقطع برش داده شده بررسی شده است. این نتیجه کمی پراکندگی را نشان داد، اما در بیشتر موارد، محتوای نیکل در نزدیکی فصل مشترک با بستر بالا بود.
فازهای آلیاژی توسط پراش اشعه ایکس بررسی شد. شکل 38 الگوی پراش اشعه ایکس رسوب های گرفته شده از موقعیت های مختلف فیلم های آبکاری شده در یک هول سل در حمامی با 3.0 و pH 4.5 را نشان می دهد. فیلم های ترسیب شده شامل Zn، Ni3Zn22 (δ) و Ni5Zn21 (γ) است که توسط سایر محققان گزارش شده است [41]. علاوه بر این، Zn(OH)2 و فاز ناشناخته دیگری هم مشاهده می شوند. رابطه بین تشکیل ترکیبات اینتر متالیک (آلیاژی) و دانسیته جریان مشخص نیست، اما غلظت بالای نیکل با تشکیل فاز گاما ارتباط دارد.

عکس 3. توزیع Zn و Ni روی سطح فیلم آبکاری شده. تصویرSEM و نقشه های Zn-L، Ni-K را نشان می دهد.
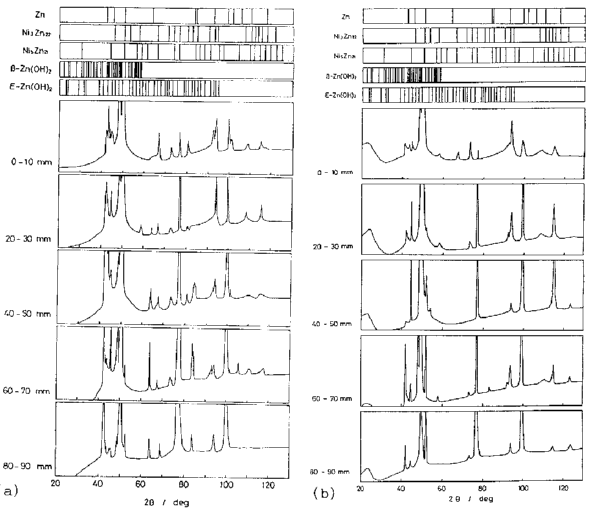
شکل 38 الگوی پراش اشعه ایکس از رسوبات مختلف فیلم پوشیده شده است. (a) در حمام در pH 3.0 قرار داده شده، (b) در حمام در pH 4.5 قرار داده شده است.
4-2. خواص خوردگی فیلم های آبکاری شده Zn-Ni
برای درک خواص بنیادین خوردگی پوشش آلیاژیZn-Ni ، فرایند خوردگی فیلم ها در محلول بافر آبی با pH 6 و محلول 3٪ NaCl مورد مطالعه قرار گرفت. نمونه های آبکاری شده تحت جریان ثابت یا دانسیته جریان متغیر در یک هول سل تهیه شدند. برای استفاده از نمونه های هول سل، نمونه ها متناسب با اختلاف دانسیته جریانی که در موقعیت های مختلف داشتند به قطعات کوچکتر برش داده شدند یا بدون برش به عنوان نمونه های غیر متجانس استفاده شدند.
تغییر پتانسیل خوردگی پوشش های آبکاری شده Zn-Ni بر روی بسترهای Cu و Fe و پوشش Zn بر روی Fe به عنوان تابعی از زمان غوطه وری در محلول بافری با pH 6 و محلول 3٪ NaCl نشان داده شده است. پتانسیل خوردگی فیلم ساده Zn، تا زمانیکه پوشش Zn روی سطح بستر وجود داشت در مقدار پایه مربوط به Zn باقی ماند. با این حال، در پوشش آلیاژی، پتانسیل خوردگی به محض غوطه ور شدن قطعه در محلول به سمت پتانسیل های نجیب تر جابجا شد و در نهایت به یک پتانسیل ثابت رسید. همچنین مشخص شد هنگامی که بستر Cu است، پتانسیل خوردگی بیشتر به سمت مقادیر نجیب حرکت می کند و به پتانسیل خوردگی Cu می رسد. در مورد بستر Fe، پتانسیل ثابت فیلم نزدیک به پتانسیل خوردگی Fe است، به طوری که طول پتانسیل مشخص نیست. به عبارت دیگر، در فیلم های آلیاژی، پتانسیل خوردگی در جهت پتانسیل های نجیب تر حرکت می کند، حتی اگر Zn در سطح باقی بماند و به یک مقدار ثابت برسد، که به پتانسیل خوردگی فیلم خورده شده مربوط می شود. این موضوع می تواند به وضوح در عکس 4 دیده می شود، که تصاویر SEM از بزرگنمایی کم و زیاد و نقشه های اشعه ایکس مشخصه های Zn-L، Ni-K مربوط به یک تصویر SEM بزرگنمایی شده از نمونه که در محلول بافر غوطه ور شده بود تا پتانسیل خوردگی به مقدار ثابت برسد را نشان می دهد. از آنجایی که خوردگی بر روی چنین نمونه ای حاصل می شود، پتانسیل خوردگی به سمت مقادیر نجیب جابجا می شود، یعنی واکنش آندی انحلال Zn با تشکیل محصولات خوردگی قطبی می شود و واکنش کاتدی با حضور نیکل دپولاریزه می شود. غیر یکنواخت بودن خوردگی می تواند باعث ایجاد شیارهای خوردگی شود. فیلم های باقی مانده به صورت جزیره های غنی از نیکل می باشند. بنابراین می توان گفت که پوشش آلیاژی Zn-Ni به دلیل خوردگی به یک سطح نجیب تبدیل شده است.
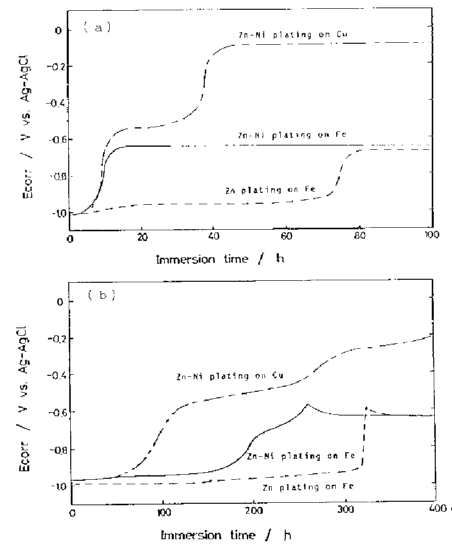
شکل 39 تغییرات پتانسیل خوردگی فیلم های پوشش داده شده بعنوان تابعی از زمان غوطه وری در محلول بافر با pH معادل 6 (a) و در محلول NaCl 3% (b). آلیاژ Ni-Zn بر روی بستر Cu و Fe، و Zn بر روی Fe آبکاری شدند.
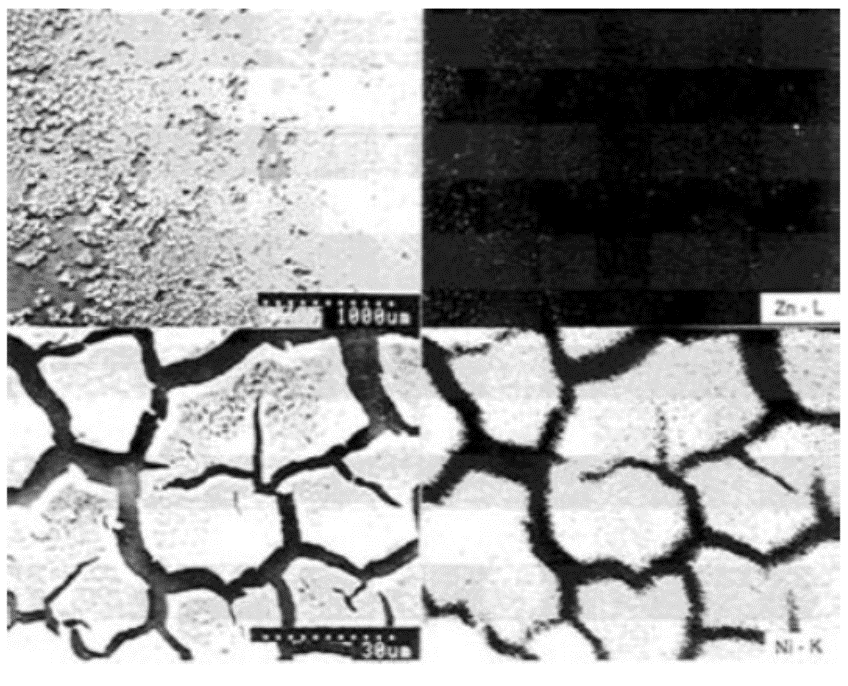
عکس 4. تصویر SEM و Zn-L، نقشه های اشعه X Ni-K از نمونه نمونه خورده شده در محلول بافر.
پتانسیل خوردگی برای فیلم های آلیاژی که از موقعیت های مختلف در یک نمونه هول سل گرفته شده است اندازه گیری شد و نتایج در شکل 40 نشان داده شده است. تمام نمونه ها تغییرات مشابهی از پتانسیل خوردگی را نشان دادند. تفاوت در زمان، ممکن است به دلیل تفاوت در مقدار محتوای Zn در فیلم باشد. ظاهر سطح این نمونه ها در طول خوردگی در عکس 5 نشان داده شده است. خوردگی غیر یکنواخت باعث ایجاد شیارهای خوردگی در تمام نمونه ها شد.
شیارهای خوردگی در فیلم ضخیم تر پخش می شوند، و با ظرافت بیشتری باعث نازکتر شدن فیلم توزیع شده می شوند.
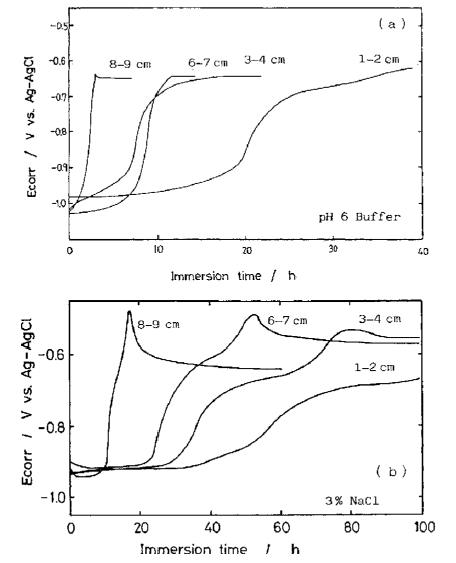
شکل 40 تغییر پتانسیل خوردگی در طول غوطه وری در محلول بافر با pH 6 (a) و در محلول NaCl 3٪ (b) برای فیلم های آبکاری شده از موقعیت های مختلف در نمونه هول سل.

عکس 5. ظاهر سطح پوشش های خورده شده که از موقعیت های مختلف بر روی نمونه هول سل گرفته شده و به طور جداگانه در محلول خوردگی قرار گرفته اند.
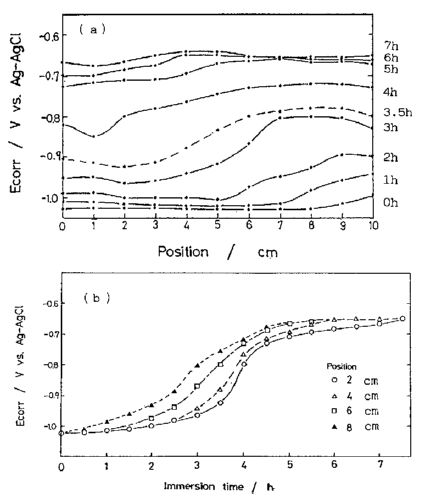
شکل 41 (a) توزیع پتانسیل خوردگی در طول آبکاری نمونه در یک هول سل بعد از دوره زمانی غوطه وری مشخص. (ب) تغییر پتانسیل خوردگی در موقعیت های مختلف بر روی نمونه به عنوان تابعی از زمان غوطه وری.
برای بررسی تأثیر عدم یکنواختی پوشش بر خواص خوردگی، آزمایشات غوطه وری بر روی نمونه های آبکاری شده در هول سل با دانسیته جریان متغیر بطور پیوسته انجام شد. پتانسیل های خوردگی در موقعیت های مختلف بر روی نمونه، همراه با جهت دانسیته جریان متغیر، بعد از چندین وقفه زمانی غوطه وری اندازه گیری شد. شکل 41 توزیع پتانسیل خوردگی در راستای جهت ضخامت متفاوت فیلم (a) و تغییر پتانسیل ها در موقعیت های مختلف در برابر زمان غوطه وری (b) را نشان می دهد. پتانسیل خوردگی در ناحیه با پوشش نازک ابتدا به سمت مقادیر پتانسیل نجیب تر حرکت می کند، و یک ماکرو-سل خوردگی در امتداد طول نمونه تشکیل می شود. با تشکیل ماکرو-سل، خوردگی نسبت به پوشش های همگن سریعتر انجام می شود. شکل خوردگی در این مورد نیز با توسعه شیارهای خوردگی همراه است. با توجه به اینکه یک سل خوردگی میکروسکوپی در امتداد شیارها تشکیل می شود و فعالیت ماکرو-سل بر روی آن قرار داده می شود، فرایند خوردگی در یک پوشش نا متجانس پیچیده است. یک نمونه از این پیچیدگی این است که زمانی که نمونه های نامتجانس در محلول 3 درصد NaCl غوطه ور می شوند زنگ قرمز در قسمتی که پوشش ضخیم است ظاهر می شود. این موضوع به صورت شماتیک در شکل 42 نشان داده شده است. در این شکل ظاهر و گسترش ناحیه زنگ قرمز در طول پیشرفت خوردگی نشان داده شده است. ظاهر شدن زنگ قرمز در قسمتی که پوشش ضخیم دارد و در آن فیلم به صورت جزیره ای با شیارهای از هم جدا شده باقی می ماند، شروع می شود.
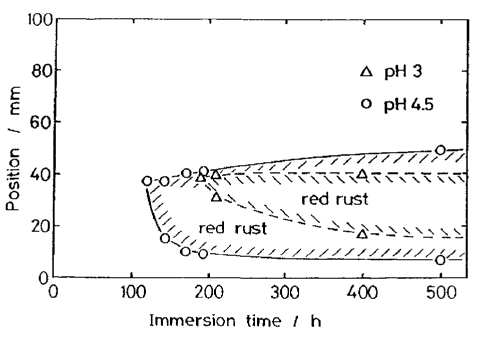
شکل 42 تغییر در ناحیه زنگ قرمز بر روی نمونه های آبکاری شده در یک هل سل با حمام های با pH 3.0 و 4.5 ، در طول خوردگی در یک محلول NaCl 3٪.
خواص خوردگی پوشش های Zn-Ni را می توان به صورت زیر خلاصه کرد: (1) با آلیاژ سازی، خوردگی اولیه شتاب می یابد و پوشش به راحتی به یک سطح الکتروشیمیایی نجیبتر تبدیل می شود؛ (2) خوردگی به طور ناهمگن ادامه می یابد و یک شیار خوردگی ترک مانند شکل می دهد. این دو ویژگی نقش بسیار پیچیده ای در بهبود مقاومت به خوردگی در بیشتر محیط های خوردگی ایفا می کنند.
4-3. مقایسه با آبکاری سایر آلیاژهای Zn
خصوصیات خوردگی فیلم های آبکاری شده آلیاژ Zn برای انواع مختلفی از سیستمهای آلیاژی مورد استفاده قرار گرفته است [38، 42-45]. مقایسه خواص آلیاژهای آبکاری شده Zn-Co، Zn-Fe و Zn-Ni جالب است. جدول 2 و عکس 6 ترکیبات حمام های آبکاری و ظاهر سطح پوشش را نشان می دهند. آزمایش های خوردگی در محلول بافری با pH 6 انجام شد. شکل 43 تغییر پتانسیلهای خوردگی Zn و آلیاژهای Zn ترسیب داده شده بر روی بسترهای Fe (a) و Cu (b) را نشان می دهد. پوششهای آلیاژی تغییرات مشابهی از پتانسیل را نشان می دهند، اما سرعت آنها متناسب با عنصر آلیاژ، متفاوت است. ظاهر پوشش ها پس از خوردگی در عکس 7 نشان داده شده است. شکل خوردگی یکسان است

عکس 6: ظاهر سطح پوششهای Zn، Zn-Co، Zn-Ni
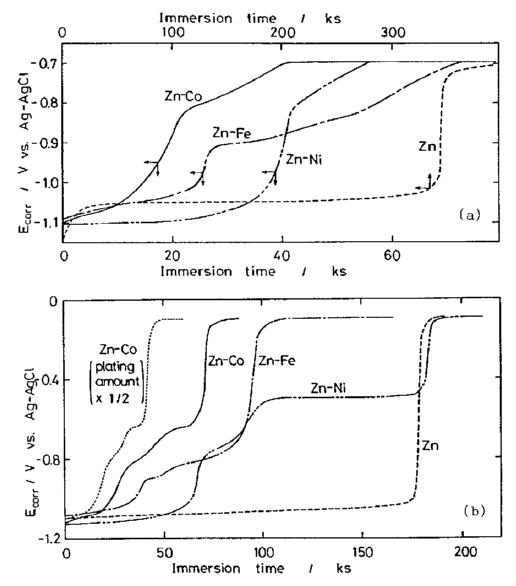
تغییر پتانسیلهای خوردگی Zn و آلیاژهای Zn ترسیب داده شده بر روی بسترهای Fe (a) و Cu (b)
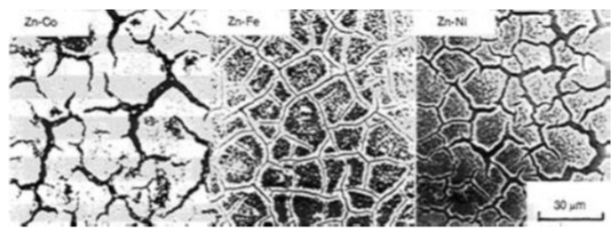
شکل 7 ظاهر سطح پوشش های Zn-Co، Zn-Fe و Zn-Ni بعد از خوردگی
برای آلیاژهای Zn-Co، Zn-Fe و Zn-Ni؛ خوردگی به طور ناهمگن باعث ایجاد شیارهای خوردگی می شود. مدت زمان خوردگی پوشش فیلم آلیاژی Zn-Ni در میان سایر آلیاژها از همه طولانی تر است و از این رو بهترین عملکرد را می توان از پوشش Zn-Ni انتظار داشت.