تئوری و واکنش های آبکاری نيكل الکترولس( شيميايي) :
*نيكل شيميايي:آبكاري شيميايي نيكل بايد موارد زير را در برداشته باشد:
*منبع ين نيكل ، بيشتر سولفات نيكل
*يك ماده احياء كننده براي تدارك الكترون مورد نياز نيكل
*انرژي (حرارت)
*مواد كمپاكس سازي كه مقدار نيكل آزاد واكنش را كنترل نمايد
* مواد تامپون ، براي ثابت نگه داشتن pHمحاول كه بخاطر توليد هيدروژن در اثناي واكنش تغيير ميكند.
*شتاب دهنده هايي كه بر سرعت واكنش مي افزايند.
* پيشگيرنده هايي كه مقدار احياء را كنترل مي نمايند.
* واكنش مواد توليد شده جنبي.
مشخصات يك محلول آبكاري شيميايي بستگي به تركيب آن از اين موارد دارد.
منبع یون نیکل:
منبع یون نیکل بیشتر سولفات نیکل می باشد.نمک های دیگر نیکل ، از جمله کلرید نیکل و استات نیکل ، برای کاربردهای بسیار محدود استفاده شده است.آنیون کلریدوقتیآبکاری ENحمام به صفحه مورد استفاده آلومینیوم ، و یا وقتی EN به عنوان پوشش محافظ آهنی استفاده می شود می تواند عمل کند در کاربردهای خوردگی آلیاژها از استات نیکل. استفاده می کنند اما هیچ بهبود قابل توجهی در عملکرد حمام و در مقایسه با کیفیت سولفات نیکل ندارد . هر گونه مزایای جزئی حاصل از استات نیکل توسط هزینه بالاتر در مقابل هزینه سولفات نیکل جبران می شود. نیکل نمک اسیدhypophosphorus ، نیکل((H2P02. منبع ایده آل از یونهای نیکل است.
مواد احيا كننده:
پاره اي از مواد احيا كننده در تهيه اين محلول به كار مي رود: سديم هيپوفسفيت و امينوبران: سديم بروهيدرات و ئيدرازين.
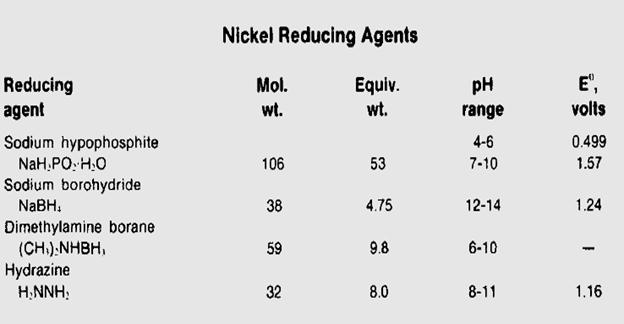
قبل از بحث در مورد کاهش عوامل و پیشنهاد مکانیسم برای واکنش هایشان با نیکل ، باید به چند نکته توجه داشته باشیم.
1-کاهش نیکل که همواره با تحول هیدروژن همراه است
2-رسوب نیکل خالص نیست و شامل فسفر ، بور و یا واکنشگر کاهشی می باشد
3-رسوب نیکل خالص تنها بر روی سطح فلزات خاص انجام میگیرد
4-یونهای هیدروژن به عنوان یک محصول جانبی واکنش کاهش تولید می شود.
5- استفاده از عامل کاهنده برای نشست فلز با توجه به نسبت مولی نیکل رسوبی به عامل کاهشی تعیین میگردد.
6-گاز نیتروژن نیز با توجه به کاهش متوسط استفاده می شود.بنابراین فلز رسوب کننده.
کمتر از 100 درصد است.
هیپوفسفیت:
واکنشها:
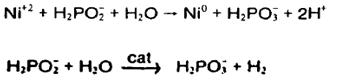
واکنش کلی:

واکنشهای سطحی ، مانند رسوب نیکل الکترولس ،را ابتدامی توان به مراحل زیر تقسیم کرد:
1. انتشار واکنشگرها Ni) ،H2PO2 – (به سطح :
2. جذب سطحی واکنشگرها در سطح ؛
3. واکنش شیمیایی در سطح ؛
4. دفع محصولات از سطح ؛
5. انتشار محصولات از سطح.
بيشتر آبكاري هاي نيكل شيميايي به ويژه آبكاري نيكل روي پلاستيك از محلول استفاده مي كنند كه احياء كنندة آن هيپوفسفيت است امتياز آن بر احيا كننده هاي ديگر ارزاني و كنترل ساده تر و مقاومت پوشش آن در برابر خوردگي است .
چندين مكانيسم براي توجيه واكنشهاي آن آمده است موردي كه بيشتر از همه مورد قبول همگان واقع شده است، مكانيسم زيرين است:
در حضور يك سطح كاتاليتيكي و انرژي به اندازة لازم و يونهاي هيپوفسفيت به ارتوفسفيت اكسيده ميشوند مقدار ئيدروژن مجذوب سطح كاتاليتيكي مي گردد. سپس نيكل در اين سطح با جذب ئيدروژن فعال احيا مي شود. در همين حال پاره اي از ئيدروژنهاي جذب شده و مقداري از هيپوفسفيت را در سطح كاتاليتيكي احياء نموده و به آب و يون ئيدروكسيل و فسفر تبديل مي كند. بيشتر هيپوفسفيت حاضر در سطح كاتاليتيكي اكسيد شده و به ارتوفسفيت و گاز ئيدروژن بدل گرديده و صرف نظر از نشست نيكل و فسفر از راندمان محلول مي كاهد. معمولاً براي نشاندن يك كيلوگرم نيكل با راندمان 37% پنج كيلوگرم سديم هيپوفسفيت لازم است.
یون بوروهیدرید:
بوروهیدریدممکن است از هر محلول آبی شامل ترکیب بوروهیدرید بدست اید.بوروهیدریدسدیممعمولا به علت در دسترس بودن آن ارجح است. بوروهیدریکه در آن بیش از 3 اتم هیدروژن ازیونبوروهیدریدجایگزین شده اند نیز می تواند مورد استفاده قرار گیرد ؛sodiumtrimethoxyborohydride) نمک راشل) نمونه ای از این نوع ترکیب می باشد.
واکنشها:
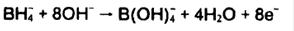
...
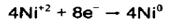
واکنش کلی:...
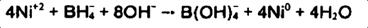
آمینوبرانها:
در ، مولکول BH3، هشتگانه بور ناقص است ، در نتیجه نقصهشتگانه، BH3 می تواند به عنوان پذیرنده الکترون رفتار اسید لوئیس داشته و بنابراین ، جفت الکترون اهدا کنندگان (باز لوئیس) ،ترکیباتی از قبیل فرم آمین است.

استفاده تجاری ازآمینوبرانها در آبکاری نیکل الکترولس است. به طور کلی استفادهازآمینوبرانها ، محدود بهdimethylamine borane (DMAB) ،کهتنها 3 هیدروژن فعال متصل به اتم بور و در نتیجه ،
3 یون نیکل برای هر مولکولDMAB کاهش مییابد اما در عمل 4 یون نیکل کاهش می یابد.
واکنشها:
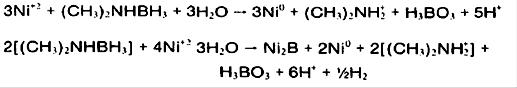
علاوه بر واکنش مفید فوق ، DMAB می تواند هیدرولیز گردد و از بین رود.
محیط اسیدی:
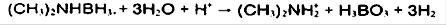
محیط بازی:
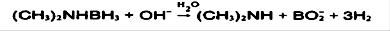
هیدرازین:
بلافاصله پس ازBrenner Riddell و یافته هایش در مورد کاهش نیکل با هیدرازین استفاده از ان صادر شد .هیدرازین به عنوان کاهندهفلز عمل میکند. در طول 16 سال ، بسیاری از مقالاتاختراعات و جزییات رسوب الکترولس نیکل فسفر منتشر شد.
هیدرازین عامل کاهنده قوی در محلول قلیایی آبی است:
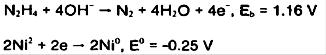
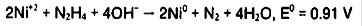
مکانیزم هیدرولیز یون نیکل را می توان با استفاده از مشاهدات تجربی در کاهش نیکل با هیدرازین اصلاح کرد:
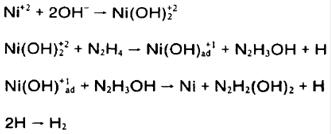
واکنش کلی:
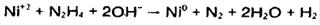
انرژي:
.
مقدار انرژي يا حرارتي كه به محلول آبكاري شيميايي نيكل داده مي شود يكي از مهمترين عواملي است كه در واكنش احيايي موثر است دما معیاری از انرژي اي است كه چنين محلولي در بر دارد. بنابراين دماي بيشتر باعث افزايش سرعت نشستن روكش مي شود البته در اين مورد نبايستي دما از 95 درجه سانتيگراد بالاتر رود زیرا باعث از بین رفتن محلول نیکل ابکاری میگردد.
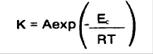
در این معادله Aفاکتور فرکانس است.بر طبق این معادله مولکول باید یک مقدار انرژی حداقل بگیرد. معادله زیر که مستقیمأ به معادله بالا مرتبط است نشاندهندهی این است که سرعت واکنش به افزایش انرژی به سیستم مرتبط است:
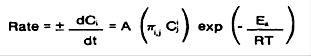
مواد كمپلكس ساز:
براي پيشگيري از تجزية همزمان محلول و كنترل واكنش بدان گونه كه تنها در سطح كاتاليتيكي و عمل تجزيه صورت گيرد مواد كمپلكس ساز افزوده مي شوند اين مواد كمپلكس ساز اسيدهاي آلي يا نمكهاي آنهاست كه براي كنترل نيكل آزاد آماده براي واكنش افزوده مي گردد كوشش آنها در جهت تثبيت محلول و كندي نشاندن فسفيت نيكل است.
اين مواد از سوي ديگر pHمحلول را ثابت نگاه داشته و از كاهش تند آن هنگامي كه يونهاي هيدروژن در واكنش احياي نيكل تشكيل مي گردند، پيشگيري مي كنند آمونياك و ئيدروكسيدها و يا كربناتها نيز بدين منظور به كار برده مي شوند.
ترمودینامیک کمک بزرگی در پیش بینی تعادل در واکنش الکتروشیمیایی است. انرژی آزاد گیبس به عنوان معیاری برای این که آیا واکنش الکتروشیمیایی سلول در درجه حرارت ثابت خود به خود رخ خواهد داد یا نه. ارتباطی مهم بین تغییر انرژی آزاد، و مقدار کار الکتریکی انجام شدهوجود دارد و توسط ، nFE ، در سلول قابل برگشت بازگو می شود.
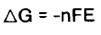
در اینجا مقدار ان برای هیپوفسفیت محاسبه گردیده است:
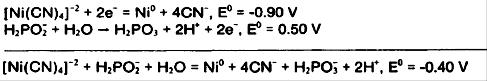
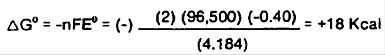
از آنجا کهΔG>0، واکنش خودبخود نخواهد بود و به مقداری انرژی نیاز دارد. از سوی دیگر واکنشhypophosphite در محلول قلیایی رادر نظر بگیرید:
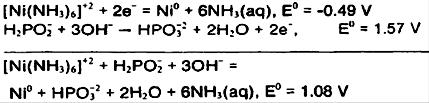
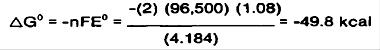
از آنجا که ΔG<0واکنش خودبخودی است.نمونه بالانشان میدهدکه عامل کمپلکس دهنده می تواند اثر عمیقی بر کاهش واکنشداشته باشد
كمپاكس سازهايي كه مورد استفاده قرار مي گيرند و نمكهاي اسيد گليكوليك و اسيد سيتريك يا اسيد استيك مي باشند اسيدهايي مانند اسيد سوكسينيك و اسيد گلوتاريك اسيد لاكتيك و اسيد پروبيونيك و اسيد امينواستيك نيز به كار مي روند.
.....
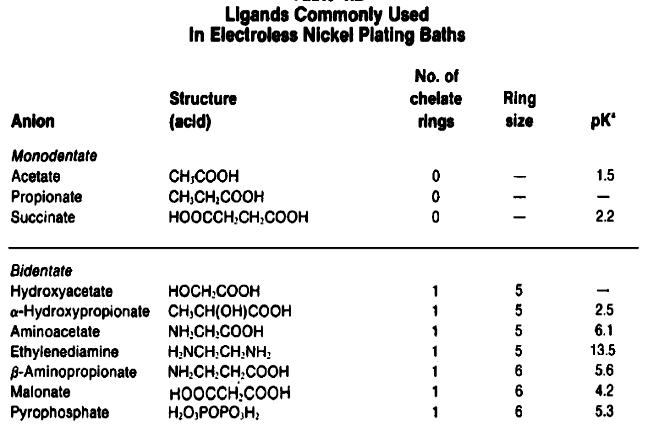
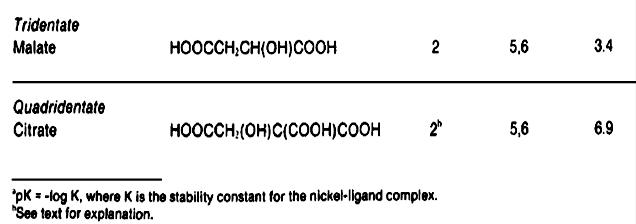
نمونهای از کمپلکس در زیر امده است:
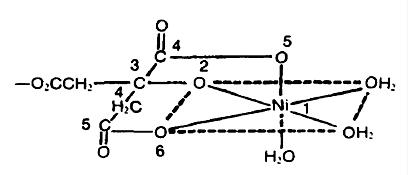
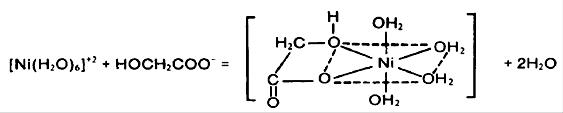
شتاب دهنده ها:
مواد كمپلكس ساز از سرعت واكنش احياي نيكل كاسته و ممكن است كه سرعت آنرا به گونه اي غير اقتصادي كند كنند براي مقابله با اين اشكال افزودنيهاي آلي كه شتاب دهنده ناميده مي شوند، اغلب به مقدار كم به محلول افزوده مي شوند كار اين مواد سست كردن بند ميان اتم ئيدروژن و اتم فسفر در مولكول هيپوفسفيت است و تا امكان حذف ودر نتيجه جذب آن به سطح كاتاليتيكي بيشتر فراهم گردد شتاب دهنده يون هيپوفسفيت را فعال نموده و به سرعت واكنش شتاب مي دهد در بيشتر موارد اسيد سوكسينيك اينكار را انجام مي دهد و اگر چه ديگر اسيدهاي كربنيك و فلوئوريدهاي محلول و پاره اي حلالها نيز بكار مي روند.
تثبیت کننده ها:
تثبیت کننده های موثر می تواند به طبقات زیر تقسیم شود:
1-کاتیونهای سنگین فلز ات: سرب و جیوه'، Sb
2-ترکیبات عناصر گروه ششم:S,Se,Te
3-ترکیبات شامل اکسیژن : AsO2- ,IO2- ,MoO22-
4-اسیدهای غیر اشباع آلی: Maleic ، Itaconic
چند روش برای تعیین اثر بخشی این ترکیبات به عنوان تثبیت کننده و همچنین غلظت مطلوب در
حمام آبکاریدر دسترس است.
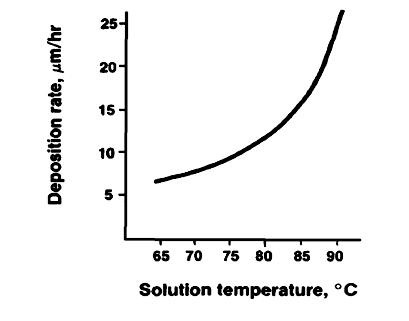
یکی از این روش هامتشکل از رسم مقدار مخلوط یا رسوب نیکل الکترولس در مقابل غلظت تثبیت کننده است .منحنی شبیه به شکل پایین بدست می آید.درشکل. همانگونه که مشاهده میگردد غلظت کوچک اولیه تثبیت کننده باعث تغییر ناگهانی در پتانسیل بدست امده و پس از آن تنها باعث تغییرات جزئی در پتانسیل مخلوط می شوند. هنگامی که غلظت تثبیت کننده به یک مقدار بحرانی می رسد پتانسیل مخلوط ناگهان به سمت صفر میرود وتوقف واکنش آبکاری را بدنبال دارد.(شکل 1)
یکی دیگر از روشها شامل اندازه گیری سرعت رسوب در مقابل غلظت تثبیت کننده است
منحنی آن در شکل زیر نشان داده شده است. برخی از منحنیهای به دست آمدهدارای محدوده غلظت کوچکتر از منحنیهای دیگر و پیک تیزتر است ، اما ویژگی مشترک بین همه انها در این است که پایدارکنندهها باعث افزایش سرعت رسوبگذاری می شوند.(شکل 2)
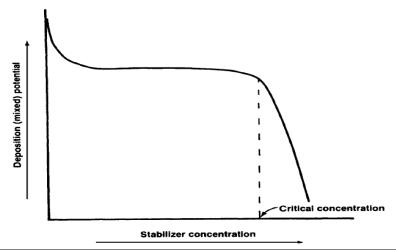
شکل1
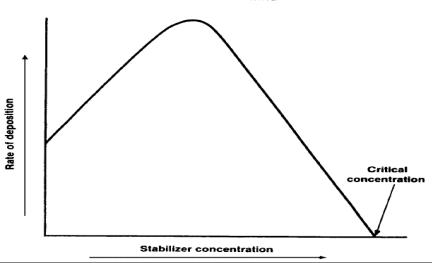
....
شکل2
....
پيش گيرنده ها:
واكنش احياي نيكل در آبكاري شيميايي آن بايد به گونه اي كنترل شود كه عمل نشست با سرعت پيش بيني شده، و تنها به روي قطعة مورد نظر صورت گيرد براي دستيابي به اين هدف و پيشگيرنده ها افزوده مي شوند محلولهاي آبكاري شيميايي نيكل مي توانند ساعتها و روزها بدون پيشگيرنده ها كار كنند و اين يكبار ممكن است كه بدون پيش بيني قبلي شروع به تجزيه نمايند.
عمل تجزيه معمولاً با پيدايش ذرات كلوئيدي و جامد در محلول آغاز مي گردد اين ذرات ممكن است ذرات خارجي (همانند گرد و خاك) باشند كه وارد محلول گرديده اند و يا خود محلول در نتيجه تراكم ارتوفسفيت بيش از مرز حلاليت آن و آنها را توليد نمايد سطح اين ذ رات صرفنظر از آنكه از چه منبعي در محلول پيدا شده اند كاتاليزوري براي شروع واكنش احيا خواهد بود كه منجر به يك واكنش زنجيره اي خود شتاب و در نتيجه واكنش احيا محلول مي گردد. اينكار معمولاً با آزادسازي ئيدروژن بيشتر و پيدايش لخته هاي سياهرنگي درون محلول همراه است.
حلاليت فسفيت در محلول و هنگامي كه مواد كمپلكس ساز همانند اسيد سيتريك يا اسيد گليكوليك افزوده مي شود در هر صورت استفاده از كمپلكس سازهاي قوي بيشتر از حد لازم آن و باعث كاهش سرعت نشست و افزايش تخلخل و براقي روكش ميگردند.
يون هيدروژن (H+):
كه در اثر واكنش احيا توليد مي گردد، pHرا پايين مي آورد pHمحلول تاثير زيادي هم در كاركرد و هم در تركيب روكش دارد براي كاهش تغييرات pHو كمك به ثابت نگاه داشتن شرايط كاري و خواص روكش و تامپونها در محلول آبكاري شيميايي نيكل بكار گرفته مي شوند. پاره اي از تامپونها كه بيشتر مورد استفاده قرار مي گيرند عبارتند از استات و پروپيونات و سوكسينات. افزايش مواد قليايي همانند محلولهاي ئيدروكسيد و كربنات يا آمونياك نيز براي خنثي نمودن اسيد تشكيل يافته در حين آبكاري بكار مي رود.
در محیطهای با 5
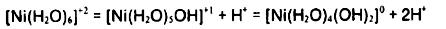

همانطور که در بالا ذکر شد معمولأ برای پایداری یون نیکل به محلول عوامل کمپلکس کننده اضافه میشود:
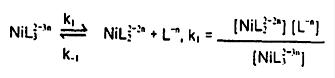
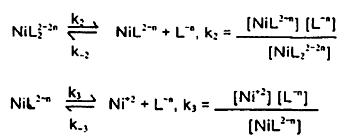
واکنش کلی عبارتست از:...
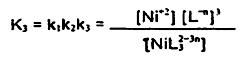
و در کل:
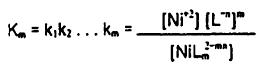
..
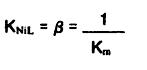
سرعت رسوب نیکل متناسب با سرعت نیکل به شکل یون آزاد است.بنابراین:
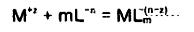
....
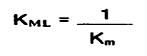
و از انجا:
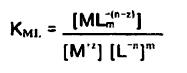
...
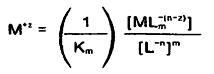
در نتیجه:
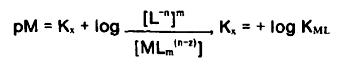
از طرفی:
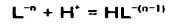
و ثابت تعادل واکنش:
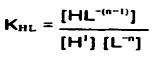
...
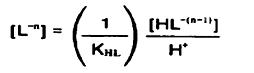
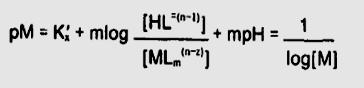
از آنجا که pMوpH مفاهیم مشابه هستند ، افزایش pMیاpH باعث کاهش غلظت یون فلزی مورد نظر میگردد.
محصولاتی که در این مقاله مورد استفاده قرار گرفت